»: Повышенный уровень лейкоцитов, бактериальная инфекция, картофель содержит крахмал, насекомые переносят заболевания эти и другие похожие высказывания приходится слышать отовсюду. Каждый день с экранов телевизоров, из уст знакомых, с полос газет и журналов нам в мозг поступает одна и та же информация. Информация, которая, как может показаться, является уделом лишь специалистов медиков и биологов. Ведь именно они касаются этих вопросов в своей повседневной жизни. Простому же человеку достаются лишь только выводы из тех или иных исследований, сухие слова, не обладающие наглядностью. В этой статье я постараюсь рассказать просто о сложном. О том, как каждый может приблизить к себе неуловимый, на первый взгляд, мир клеток и микроорганизмов.
Вот уже два года, как я наблюдаю за этим миром у себя дома, и год, как делаю фотоснимки. За это время я успел увидеть собственными глазами, какие бывают клетки крови, что опадает с крыльев бабочек и молей, как бьётся сердце у улитки. Конечно, многое можно было бы почерпнуть из учебников, видеолекций и с тематических веб-сайтов. Единственное, что осталось бы не почерпнутым - это ощущение присутствия и близости к тому, чего не видно невооружённым глазом. То, что прочитано в книге или увидено в телепередаче, скорее всего, сотрется из памяти в весьма сжатые сроки. Что увидено лично в объектив микроскопа - останется с тобой навсегда. И останется не столько сам образ увиденного, сколько понимание, что мир устроен именно так, а не иначе. Что это не просто слова из книжки, а личный опыт. Опыт, который в наше время доступен каждому.
Что купить?
Театр начинается с вешалки, а исследование - с покупки оборудования. В нашем случае это будет микроскоп, ибо в лупу много не разглядишь. Из основных характеристик микроскопа «для домашних нужд» стоит выделить, конечно же, набор доступных увеличений, которые определяются произведением увеличений окуляра и объектива. Не всякий биологический образец хорош для исследования на больших увеличениях. Связано это с тем, что большее увеличение оптической системы предполагает меньшую глубину резкости. Следовательно, изображение неровных поверхностей препарата частично будет размыто. Поэтому важно иметь набор объективов и окуляров , позволяющий вести наблюдения во всем диапазоне увеличения: 10–20×, 40–60×, 100–200×, 400–600×, 900–1000×. Иногда бывает оправдано увеличение 1500×, достигающееся при покупке окуляра 15× и объектива 100×. Всё, что увеличивает сильнее, разрешающей способности заметно не прибавит, так как на увеличениях около 2000–2500× уже близок так называемый «оптический предел », обусловленный дифракционными явлениями.
Следующим немаловажным моментом является тип насадки. Обычно выделяют монокулярную, бинокулярную и тринокулярную разновидности. Принцип классификации основывается на том, «сколькими глазами» вы хотите смотреть на объект. В случае монокулярной системы вам придётся щуриться, постоянно меняя глаза от усталости при длительном наблюдении. Здесь вам на помощь придёт бинокулярная насадка, в которую, как и следует из её названия, можно глядеть обоими глазами. В целом, это более благоприятно скажется на самочувствии ваших глаз. Не следует путать бинокуляр со стереомикроскопом. Последний позволяет добиться объёмного восприятия наблюдаемого объекта за счёт наличия двух объективов, в то время как бинокулярные микроскопы просто подают на оба глаза одно и то же изображение. Для фото- и видеосъёмки микрообъектов понадобится «третий глаз», а именно насадка для установки камеры. Многие производители выпускают специальные камеры для своих моделей микроскопов, хотя можно использовать и обычный фотоаппарат (правда, при этом придётся купить переходник).
Наблюдение при больших увеличениях требует хорошего освещения в силу небольшой апертуры соответствующих объективов. Канули те времена, когда препарат исследовали в отражённом от зеркала свете. Сейчас микроскопы представляют собой комплексные оптико-механо-электрические приборы, в которых всецело используются достижения научно-технического прогресса. В современных устройствах имеется своя лампочка, свет от которой распространяется через специальное устройство - конденсор , - которое и освещает препарат. В зависимости от типа конденсора можно выделить различные способы наблюдения, самыми популярными из которых являются методы светлого и тёмного поля. Первый метод, знакомый многим ещё со школы, предполагает, что препарат освещается равномерно снизу. При этом в тех местах, где препарат оптически прозрачен, свет распространяется от конденсора в объектив, а в непрозрачной среде свет поглощается, приобретает окраску и рассеивается. Поэтому на белом фоне получается тёмное изображение - отсюда и название метода.
С темнопольным конденсором всё иначе. Он устроен так, что лучи света, выходящие из него, направлены в разные стороны, кроме непосредственно отверстия объектива. Поэтому они проходят сквозь оптически прозрачную среду, не попадая в поле зрения наблюдателя. С другой стороны, лучи, попавшие на непрозрачный объект, рассеиваются на нём во все стороны, в том числе и в направлении объектива. Поэтому в итоге на тёмном фоне будет виден светлый объект. Такой метод наблюдения хорош для исследования прозрачных объектов, которые на светлом фоне не являются контрастными. По умолчанию большинство микроскопов являются светлопольными. Поэтому, если вы планируете расширить набор методов наблюдения, то стоит выбирать модели микроскопов, в которых предусмотрена установка дополнительного оборудования: конденсоров, устройств фазового контраста, поляризаторов и т.п.
Как известно, оптические системы не идеальны: прохождение света через них сопряжено с искажениями изображения - аберрациями . Поэтому объективы и окуляры стараются изготавливать так, чтобы эти аберрации максимально устранить. Всё это сказывается на их конечной стоимости. Из соображений цены и качества имеет смысл покупать планахроматические объективы. Они используются при профессиональных исследованиях и имеют адекватную цену. Объективы с большим увеличением (например, 100×) имеют числовую апертуру больше 1, что предполагает использование масла при наблюдении - так называемая иммерсия . Поэтому, если кроме «сухих» объективов вы берёте ещё и иммерсионные, стоит заранее позаботиться об иммерсионном масле. Его показатель преломления обязательно должен соответствовать вашему конкретному объективу.
Конечно, это не весь список параметров, которые следует учитывать при покупке микроскопа. Иногда бывает важно обратить внимание на устройство и расположение предметного столика и рукояток для управления им. Стоит выбрать и тип осветителя, которым может быть как обычная лампа накаливания, так и светодиод, который светит ярче и греется меньше. Также микроскопы могут иметь индивидуальные особенности. Но основное, что стоило бы сказать об их устройстве, пожалуй, сказано. Каждая дополнительная опция - это добавка к цене, поэтому выбор модели и комплектации - это удел конечного потребителя.
В последнее время наметилась тенденция покупки микроскопов для детей. Такие устройства обычно являются монокулярами с небольшим набором объективов и скромными параметрами, стоят недорого и могут послужить хорошей отправной точкой не только для непосредственно наблюдений, но и для ознакомления с основными принципами работы микроскопа. После этого ребёнку уже можно будет купить более серьёзное устройство на основании выводов, сделанных при работе с «бюджетной» моделью.
Как смотреть?
Любительское наблюдение не предполагает исключительных навыков ни в работе с микроскопом, ни в подготовке препаратов. Конечно, можно купить далеко не дешёвые наборы уже готовых препаратов, но тогда не таким ярким будет ощущение вашего личного присутствия в исследовании, да и готовые препараты рано или поздно наскучат. Поэтому, купив микроскоп, стоит задуматься о реальных объектах для наблюдения. Кроме того, вам понадобятся хоть и специальные, но доступные средства для подготовки препаратов.
Наблюдение в проходящем свете предполагает, что исследуемый объект является достаточно тонким. Даже не каждая кожура с ягоды или фрукта сама по себе обладает необходимой толщиной, поэтому в микроскопии исследуют срезы. В домашних условиях достаточно адекватные срезы можно делать обычными лезвиями для бритья. При определённой сноровке можно достигнуть толщины среза в несколько клеточных слоёв, что во многом повысит дифференцируемость объектов препарата. В идеале стоит работать с моноклеточным слоем ткани, ибо несколько слоёв клеток, наложенных друг на друга, создают нечёткое и сумбурное изображение.
Исследуемый препарат помещается на стекло предметное и, в случае необходимости, накрывается стеклом покровным. Поэтому, если в комплекте к микроскопу стёкла не прилагаются, их следует купить отдельно. Сделать это можно в ближайшем магазине медицинской техники. Однако не каждый препарат хорошо прилегает к стеклу, поэтому применяют методы фиксации. Основными являются фиксация огнём и спиртом. Первый метод требует определённого навыка, так как можно попросту «спалить» препарат. Второй способ зачастую более оправдан. Чистый спирт достать не всегда возможно, поэтому в аптеке в качестве заменителя можно приобрести антисептик, который, по сути, является спиртом с примесями. Там же стоит купить йод и зелёнку. Эти привычные для нас средства дезинфекции на деле оказываются ещё и хорошими красителями для препаратов. Ведь не всякий препарат открывает свою сущность при первом взгляде. Иногда ему нужно «помочь», подкрасив его форменные элементы: ядро, цитоплазму, органеллы.
Для взятия образцов крови следует приобрести скарификаторы, пипетки и вату. Всё это есть в продаже в медицинских магазинах и аптеках. Кроме того, для сбора объектов из дикой природы следует запастись маленькими пакетиками и баночками. Брать с собой баночку для набора воды из ближайшего водоёма при выезде на природу должно стать у вас хорошей привычкой.
Что смотреть?
Микроскоп приобретён, инструменты закуплены - пора начинать. И начать следует с самого доступного. Что может быть доступнее кожуры репчатого лука (рис. 1 и 2)? Являясь тонкой сама по себе, кожура лука, будучи подкрашенной йодом, обнаруживает в своём строении чётко дифференцируемые ядра. Этот опыт, хорошо знакомый со школы, пожалуй, и стоит провести первым. Саму кожуру лука нужно залить йодом и оставить окрашиваться на 10–15 минут, после чего нужно промыть её под струёй воды.
Кроме того, йод можно использовать для окраски картофеля (рис. 3). Не стоит забывать, что срез необходимо делать как можно более тонким. Буквально 5–10 минут пребывания среза картофеля в йоде проявят пласты крахмала, которые окрасятся в синий цвет. Йод является достаточно универсальным красителем. Им можно окрашивать широкий спектр препаратов.
Рисунок 1. Кожица лука (увеличение: 1000×). Окраска йодом. На фотографии дифференцируется ядро в клетке.

Рисунок 2. Кожица лука (увеличение: 1000×). Окраска Азур-Эозином. На фотографии в ядре дифференцируется ядрышко.

Рисунок 3. Зерна крахмала в картофеле (увеличение: 100×). Окраска йодом.
На балконах жилых домов часто скапливается большое количество трупов летающих насекомых. Не торопитесь от них избавляться: они могут послужить ценным материалом для исследования. Как видно из фотографий, вы обнаружите, что крылья насекомых волосатые (рис. 4–6). Насекомым это необходимо для того, чтобы крылья не намокали . В силу большого поверхностного натяжения, капли воды не могут «провалиться» сквозь волоски и коснуться крыла.
Это явление называется гидрофобностью . Подробно мы о нем говорили в статье «Физическая водобоязнь ». - Ред.

Рисунок 4. Крыло божьей коровки (увеличение: 400×).

Рисунок 5. Крыло бибионида (увеличение: 400×).

Рисунок 6. Крыло бабочки боярышницы (увеличение: 100×).
Если вы когда-нибудь задевали крыло бабочки или моли, то, наверное, замечали, что с неё слетает какая-то «пыль». На фотографиях отчётливо видно, что этой пылью являются чешуйки с их крыльев (рис. 7). Они имеют разную форму и достаточно легки на отрыв.
Кроме того, можно поверхностно изучить строение конечностей членистоногих (рис. 8), рассмотреть хитиновые плёнки - например, на спине таракана (рис. 9). При должном увеличении можно убедиться, что такие плёнки состоят из плотно прилегающих (возможно, сросшихся) чешуек.

Рисунок 7. Чешуйки с крыльев моли (увеличение: 400×).

Рисунок 8. Конечность паука (увеличение: 100×).

Рисунок 9. Плёнка на спине таракана (увеличение: 400×).
Следующее, что стоило бы понаблюдать - это кожура ягод и фруктов (рис. 10 и 11). Не все фрукты и ягоды обладают приемлемой для наблюдения в микроскоп кожурой. Либо её клеточное строение может быть не дифференцируемым, либо толщина не позволит добиться чёткого изображения. Так или иначе, придётся сделать немало попыток, прежде чем вы получите хороший препарат. Вам придётся перебрать разные сорта винограда - например, для того, чтобы найти тот, у которого красящие вещества в кожуре имели бы «приятную для глаза» форму, или сделать несколько срезов кожицы сливы, пока не добьётесь моноклеточного слоя. В любом случае, вознаграждение за проделанную работу будет достойным.

Рисунок 10. Кожура чёрного винограда (увеличение: 1000×).

Рисунок 11. Кожура сливы (увеличение: 1000×).

Рисунок 12. Лист клевера (увеличение: 100×). Некоторые клетки содержат тёмнокрасный пигмент.
Достаточно доступным для исследования объектом является зелень: трава, водоросли, листья (рис. 12 и 13). Но, несмотря на повсеместную распространённость, выбрать и приготовить хороший образец бывает не так-то просто.
Самым интересным в зелени являются, пожалуй, хлоропласты (рис. 14 и 15). Поэтому срез должен быть исключительно тонким. Нередко приемлемой толщиной обладают зелёные водоросли, встречающиеся в любых открытых водоёмах.

Рисунок 13. Лист земляники (увеличение: 40×).Рисунок 16. Плавающая водоросль со жгутиком (увеличение: 400×).

Рисунок 17. Детёныш улитки (увеличение: 40×).

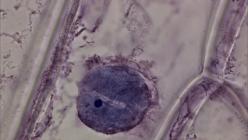
Рисунок 18. Мазок крови. Окраска Азур-Эозином по Романовскому (увеличение: 1000×). На фотографии эозинофил на фоне эритроцитов.
Сам себе учёный
Видео 1. Биение сердца улитки (увеличение оптического микроскопа 100×).
После исследования простых и доступных препаратов естественным желанием является усложнение техник наблюдения и расширение класса изучаемых объектов. Для этого, во-первых, понадобится литература по специальным методам исследования, а, во-вторых, специальные средства. Эти средства, хотя и являются своими для каждого типа объектов, всё-таки обладают некоторой общностью и универсальностью. Например, всеобще известный метод окраски по Граму, когда разные виды бактерий после окраски дифференцируются по цветам, может быть применён и при окраске других, не бактериальных, клеток. Близким к нему по сути является и метод окраски мазков крови по Романовскому. В продаже имеется как уже готовый жидкий краситель, так и порошок, состоящий из таких красящих веществ, как азур и эозин. Все красители можно купить в специализированных медико-биологических магазинах, либо заказать в интернете. Если же по каким-то причинам вы не можете достать краситель для крови, можно попросить лаборанта, делающего вам анализ крови в больнице, приложить к анализу стёклышко с окрашенным мазком вашей крови.
Продолжая тему исследования крови, нельзя не упомянуть камеру Горяева - устройство для подсчёта форменных элементов крови. Будучи важным инструментом для оценки количества эритроцитов в крови ещё в те времена, когда не было устройств для автоматического анализа её состава, камера Горяева также позволяет измерять размеры объектов благодаря нанесённой на неё разметке с известными размерами делений. Методы исследования крови и других жидкостей с помощью камеры Горяева описаны в специальной литературе.
Заключение
В данной статье я постарался рассмотреть основные моменты, связанные с выбором микроскопа, подручных средств и основные классы объектов для наблюдения, которые нетрудно встретить в быту и на природе. Как уже было сказано, специальные средства наблюдения предполагают наличие хотя бы начальных навыков работы с микроскопом, поэтому их обзор выходит за рамки данной статьи. Как видно из фотографий, микроскопия может стать приятным хобби, а может быть, для кого-то даже и искусством.
В современном мире, где разнообразные технические средства и устройства находятся в шаговой доступности, каждый сам решает, на что ему потратить собственные деньги. Из развлекательных соображений это может быть дорогостоящий ноутбук или телевизор с запредельным размером диагонали. Но находятся и те, кто отводит свой взор от экранов и направляет его либо далеко в космос, приобретая телескоп, либо, смотря в окуляр микроскопа, проникают взглядом глубоко внутрь. Внутрь той природы, частью которой мы являемся.
Литература
- Ландсберг Г.С. (2003). Оптика. § 92 (стр. 301);
- Гуревич А.А. (2003). Пресноводные водоросли;
- Козинец Г.И. (1998). Атлас клеток крови и костного мозга;
- Коржевский Д.Э. (2010). Основы гистологичесой техники..
1. Для чего используются микропрепараты?
Микропрепараты используются для изучения под микроскопом тончайших срезов объектов.
2. Как приготовить микропрепарат?
Берут либо сам объект, либо делают тончайший срез, и помещают его на предметное стекло в каплю воды, а затем накрывают сверху покровным стеклом.
3. Какое лабораторное оборудование необходимо для приготовления микропрепаратов?
Покровное и предметное стекла, игла.
4. Почему под микроскопом можно изучать только очень мелкие биологические объекты или их тонкие срезы?
Микроскоп дает большое увеличение, что удобно при рассмотрении мельчайших объектов.
5. Перед исследователем стоит задача изучить внутреннее строение черешка листа бегонии. Опишите последовательность действий исследователя.
Сначала исследователи сделают тонкий срез черешка листа бегонии, затем приготовят с ним микропрепарат и, отрегулировав микроскоп, приступят в его изучению.
Лабораторная работа 2. Приготовление простейших микропрепаратов
Цель: научиться изготавливать простейшие микропрепараты и
Для изучения микроорганизмов производят микроскопирование как живых, так и убитых микробов в неокрашенном и окрашенном виде. Микроскопический препарат готовят на предметном стекле - пластинке из тонкого стекла (76х26 мм) с хорошо отшлифованными краями. Предметные стекла, употребляемые при микробиологическом исследовании, должны быть кристально чисты и абсолютно обезжирены. На поверхности обезжиренного стекла вода легко расплывается и не образует капель шаровидной формы.
Новые стекла перед употреблением кипятят в 1%-ном растворе соды 10 мин, промывают водой, слабой соляной кислотой и хорошо прополаскивают в дистиллированной воде. Стекла, бывшие в употреблении, необходимо обработать раствором серной кислоты в течение 2 ч, хорошо промыть в воде и прокипятить 10 мин в 4%-ном растворе соды. Ополоснутые затем дистиллированной водой стекла протирают чистой полотняной тряпочкой.
В лаборатории всегда следует иметь запас готовых для работы стекол. Хранить предметные стекла лучше всего в банке с притертой пробкой, погруженными в смесь спирта с эфиром, взятых в равных объемах. Из банки предметные стекла достают пинцетом. Покровные стекла - вырезанные квадратом или прямоугольником тонкие стеклышки (толщиной 0,15-0,17 мм) размерами 18х18 мм, 20х20 мм, 18х24 мм.
Исследование микроорганизмов в живом виде
Микроорганизмы можно микроскопировать как в живом, так и в мертвом (фиксированном) состоянии на специально приготовленных препаратах. Плесневые грибы и дрожжи лучше рассматривать в живом виде в препарате «раздавленная» капля. Клетки этих микроорганизмов относительно крупные, и обычно при микроскопировании в живом виде хорошо выявляются их форма, размеры, некоторые детали внутреннего строения, а также характер размножения (почкование, деление, спорообразование и т.д.).
Бактерии ввиду их малых размеров чаще рассматривают в мертвом виде на фиксированных окрашенных препаратах. При этом получается более ясное представление о форме и размерах клеток, о способности их к спорообразованию. В живом виде в «раздавленной» капле бактерии рассматривают в том случае, когда выясняют их способность к движению.
Препарат «раздавленная» капля. На обезжиренное предметное стекло прокаленной петлей наносят каплю стерильной воды, в которую той же петлей вносят небольшое количество исследуемой культуры микроорганизма (дрожжей или бактерий), взятой с твердой питательной среды. Из жидкой среды культуру берут вместе с каплей жидкости, а при надобности добавляют каплю стерильной воды. Суспензия культуры микробов на стекле должна давать лишь слабую муть. При микроскопировании дрожжей в каплю жидкости на стекле добавляют петлей небольшое количество метиленовой сини (до голубого окрашивания) и всю эту смесь тщательно размешивают. Прижизненная окраска дрожжей метиленовой синью применяется для того, чтобы выявить мертвые клетки, легко окрашивающиеся в синий цвет. Живые клетки остаются неокрашенными, так как не пропускают краску через свою оболочку.
Приготовленный на предметном стекле препарат дрожжей накрывают покровным стеклом и рассматривают с объективом 40Х. В таком препарате обычно хорошо видны прозрачные овальные или круглые клетки дрожжей с ядрами и оболочками, которые хорошо заметны в клетках живых дрожжей. Мертвые клетки, как правило, более мелкие по сравнению с живыми м окрашены в синий цвет.
Препарат живых бактерий готовится подобно препарату дрожжей, но бактерии можно рассматривать и без добавления краски. На поверхность покровного стекла наносится капля иммерсионного масла, и препарат рассматривается с иммерсионным объективом 90 X, лучше всего в затемненном поле (т.е. с прикрытой диафрагмой). Если культура бактерий подвижная, то хорошо видны быстрые разнохарактерные движения отдельных клеток.
Для приготовления препарата плесневых грибов очень осторожно (чтобы не разрушить органов спороношения) специальной иглой (можно препаровальной) или ботаническим пинцетом снимают кусочек пленки гриба и переносят его в каплю воды, предварительно нанесенную на предметное стекло. Препарат осторожно, слегка придавливая, накрывают покровным стеклом и рассматривают под микроскопом с объективом 8Х. При этом увеличении хорошо различается строение органов спороношения плесневых грибов. Для подробного изучения отдельных деталей строения (гиф, сумок и т.д.) препарат рассматривают с объективом 40X. При этом обязательно следует регулировать освещение с помощью диафрагмы для получения более четкого изображения рассматриваемых деталей.
При приготовлении препаратов в раздавленной капле нужно помнить следующее:
1. При опускании покровного стекла на каплю следует прикоснуться его ребром к краю капли и, постепенно наклоняя, опустить стекло.
2. Капля не должна быть большой, чтобы жидкость не переливалась за края и не попадала на верхнюю сторону покровного стекла. Избыток воды снимают кусочком фильтровальной бумаги.
3. Одиночные пузырьки воздуха, оставшиеся под покровным стеклом, обычно не мешают наблюдению. Но если пузырьков много, препарат следует приготовить заново.
4. Препарат не должен быть слишком густым, чтобы микроорганизмы не заслоняли друг друга.
5. Приготовленные препараты рассматривают немедленно (особенно живых бактерий), так как в противном случае вода высыхает и клетки бактерий теряют подвижность.
6. Бактериологическую петлю (или иглу) перед каждым очередным пассажем и после него (нанесение капли воды на стекло, снятие культуры с агара и ее размешивание, взятие краски и т.д.) следует обязательно докрасна прокаливать в пламени горелки.
После прокаливания петлю быстро охлаждают на воздухе (держат 2-3 сек, ни к чему не прикасаясь) и приступают к выполнению очередного этапа работы.
Исследование микроорганизмов в фиксированном и окрашенном виде
Приготовление мазка. На чистое обезжиренное предметное стекло платиновой петлей наносят материал (рис. 62). Если он жидкий, то каплю, взятую петлей, непосредственно равномерно распределяют по поверхности предметного стекла тонким слоем на площади примерно в 1 см2. Если же изучается агаровая культура, то на предметное стекло предварительно наносят каплю стерильной воды, в которой тонким слоем распределяется исследуемая культура. Получается так называемый мазок. Все манипуляции по приготовлению мазка необходимо выполнять с соблюдением правил асептики (над пламенем горелки стерилизуют петли, концы сосудов с исследуемым материалом, ватные пробки и пр.). Сделав мазок, его сушат при комнатной температуре, поместив на специальный сушильный столик (рис. 63). Хороший мазок после сушки должен давать едва заметный налет. Препарат с густым мазком для наблюдения малопригоден.

Для ускорения высыхания можно осторожно подсушить мазок над пламенем горелки. Предметное стекло в этом случае над пламенем горелки держат так, чтобы мазок был обращен вверх.
Фиксация мазка. Предметное стекло с высушенным мазком, обращенным вверх от пламени горелки, проводят 3-4 раза на границе между светлой и темной частью пламени. Цель фиксации - убить микробные клетки, прикрепить их к стеклу и облегчить окрашивание. Мертвые клетки гораздо лучше воспринимают краску, чем живые. Препарат в общей сложности не должен находиться в пламени более 2 сек. Излишнего нагревания мазков нужно избегать, так как при этом сильно изменяется структура клеток, мазок будет плохо окрашиваться. При недостаточной же фиксации мазка его можно смыть при последующей окраске. Практически достаточность нагревания определяют прикладывая предметное стекло к руке. При этом должен чувствоваться легкий ожог.

Окраска мазков. В лабораторной практике пользуются простыми и сложными методами окраски микробов. Сложные, или дифференциальные, способы окраски, как уже указывалось, применяются для детального изучения структуры клеток. При простой окраске препаратов на фиксированный мазок наливают несколько капель какого-либо красящего раствора (метиленовой сини, разведенного фуксина и пр.). Для получения более чистых препаратов рекомендуется красящий раствор наливать на отрезок фильтровальной бумаги, которой покрывают мазок. Раствор краски в среднем выдерживают на мазке 2-3 мин (в зависимости от вида краски). Фуксин красит интенсивно, причем окрашиваются одинаково хорошо все виды бактерий. Продолжительность окрашивания раствором фуксина вполне достаточна на протяжении 1-2 мин. Щелочную метиленовую синь оставляют для окрашивания мазка на 2-3 мин. Она красит менее сильно, но препарат получается более изящный, к тому же различные бактерии приобретают окраску различной интенсивности. При окраске метиленовой синью у крупных клеток (например, дрожжевых) дифференцируется ядро и цитоплазма. Раствор генцианвиолета держат для окраски 3-5 мин.
По истечении указанного срока краску сливают с предметного стекла. Если на мазок помещалась фильтровальная бумага, ее нужно осторожно снять пинцетом и затем промыть мазок легкой струей дистиллированной воды (можно и водопроводной). Струю воды следует направлять на ребро предметного стекла, а не на мазок. Промытый препарат высушивают на воздухе при комнатной температуре или с помощью полосок фильтровальной бумаги.
На сухой мазок наносят каплю кедрового масла. Не следует кедровое масло наносить на влажный (а тем более на мокрый) мазок. При этом возникает эмульсия воды в кедровом масле и четкость изображения в микроскопе резко снижается.
Сущность сложных методов окраски заключается в том, что препарат окрашивают не одной, а двумя и большим количеством контрастных красок. В микробиологической практике сложный метод окраски микробов по Граму имеет весьма важное значение при дифференциации микробов.
Техника окраски микробов методом Грама состоит в следующем. На фиксированный мазок кладут полоску фильтровальной бумаги и наливают карболовый раствор генцианвиолета на 1-2 мин. Затем краску сливают. Сняв бумажку и не промывая препарат водой, наносят на мазок раствор Люголя также на 1-2 мин (мазок чернеет). По истечении указанного времени раствор Люголя сливают с предметного стекла и погружают стекло в стаканчик со спиртом для обесцвечивания. Предметное стекло слегка покачивают в спирте, выдерживая 30-60 сек. Быстро промывают мазок водой и дополнительно окрашивают разведенным фуксином в течение 1-2 мин. Фуксин сливают, препарат промывают водой, высушивают и микроскопируют.
Выполнить окраску микробов по Граму можно, пользуясь модификацией этого метода, предложенной Синевым. Вместо раствора карболового генцианвиолета используют фильтровальную бумагу, пропитанную этим раствором и высушенную. На фиксированный мазок накладывают полоску такой бумаги, наносят несколько капель стерильной воды, так чтобы бумажка оказалась смоченной, и окрашивают препарат в течение 2 мин. Затем бумажку снимают, на препарат наливают раствор Люголя и далее поступают так же, как указано выше при окраске по Граму.
По отношению к окраске по Граму все бактерии разделяют на две группы: грамположительные (грампозитивные) и грамотрицательные (грамнегативные). Первые в результате окраски остаются окрашенными в фиолетовый цвет; вторые - обесцвечиваются спиртом и при дополнительном окрашивании фуксином приобретают красный цвет. Объясняется это тем, что у грамположительных бактерий в цитоплазме клеток содержатся специфические белки и магниевая соль рибонуклеиновой кислоты, которые с генцианвиолетом и йодом образуют комплекс фиолетового цвета, не разрушающийся под действием спирта. У грамотрицательных бактерий магниевая соль рибонуклеиновой кислоты в клетках отсутствует, и такого комплекса при окраске генцианвиолетом и йодом в цитоплазме не образуется. Генцианвиолет и йод в дальнейшем легко обесцвечиваются спиртом.
Приготовление красящих растворов
При бактериологическом исследовании для окраски микробов применяются основные анилиновые краски. Чаще всего употребляются: основной фуксин (красная краска), метиленовая синь (синяя краска), генцианвиолет, кристаллвиолет, метилвиолет (фиолетовые краски). Эти краски продаются в виде аморфных или кристаллических порошков, из которых готовят красящие растворы.
Исходным материалом для приготовления необходимых рабочих красок являются насыщенные спиртовые растворы указанных красителей. Спиртовые растворы готовят впрок и сохраняют в склянках с притертыми пробками. Сами по себе спиртовые растворы для окраски микробов не применяются.
Насыщенный спиртовой раствор красителя получают растворением 1 г его в 10 мл 96%-ного этилового спирта (этанола). Краска обычно полностью не растворяется, и на дне флакона остается небольшой осадок. Полученный спиртовой раствор настаивают 3-5 дней, ежедневно взбалтывая.
Рабочий водно-спиртовой раствор краски получают смешивая 1 мл насыщенного спиртового раствора с 10 мл дистиллированной воды. Для повышения красящей способности в качестве протравы к водно-спиртовым растворам красок добавляют карболовую кислоту.
Рецепты приготовления наиболее употребительных красок.
Карболовый фуксин Циля. 10 мл насыщенного спиртового раствора основного фуксина смешивают со 100 мл 5%-ной карболовой кислоты. Можно приготовить красящий раствор и непосредственно из сухого красителя. Для этого 1 г основного фуксина растирают в ступке с 5 г кристаллической карболовой кислоты. Для лучшего растирания рекомендуется добавить несколько капель глицерина. Затем понемногу приливают 10 мл 96%-ного спирта. К равномерно растертой массе постепенно приливают 100 мл дистиллированной воды, перемешивают и оставляют на 1-2 суток. Затем фильтруют через бумажный фильтр. Фуксин Циля стоек и может сохраняться очень долго. Его употребляют для окраски спор и кислотоустойчивых бактерий, трудно воспринимающих краску.
Фуксин Пфейфера (разведенный фуксин). 1 мл карболового фуксина Циля смешивают с 9 мл дистиллированной воды. Раствор нестоек, поэтому его приготовляют непосредственно перед окраской препаратов. Используют для простой окраски мазков и дополнительной окраски их по методу Грама.
Карболовый генцианвиолет. 10 мл насыщенного спиртового раствора генцианвиолета смешивают со 100 мл 5%-ной карболовой кислоты или 1 г генцианвиолета растирают в ступке с 5 г кристаллической карболовой кислоты, постепенно добавляют 10 мл 96%-ного спирта и 100 мл дистиллированной воды.
Щелочная метиленовая синь (по Лефлеру). К 100 мл дистиллированной воды прибавляют 30 мл насыщенного спиртового раствора краски и 1 мл 1%-ного раствора едкого кали (КОН). Раствор фильтруют. Краска очень прочная, причем красящая способность старой краски выше, чем свежеприготовленной.
Водный раствор метиленовой сини. 1 г метиленовой сини растворяют в 100 мл дистиллированной воды.
Раствор Люголя. 2 г йодистого калия растворяют в 5 мл дистиллированной воды, прибавив 1 г кристаллического йода. Объем доводят водой до 300 мл. Раствор Люголя должен иметь слабощелочную или нейтральную реакцию. При кислой реакции его нейтрализуют (по лакмусу) двууглекислой содой. Раствор следует хранить в склянках из темного стекла, предохраняя от действия света.
Приготовление пропитанной генцианвиолетом фильтровальной бумаги для окраски микробов по Граму в модификации Синева. Раствор карболового генцианвиолета помещают на сутки в термостат при 37 °С, затем фильтруют через бумажный фильтр. Фильтрат выливают в тарелку и погружают в него нарезанную полосками фильтровальную бумагу на 1-2 мин. Пропитанная краской бумага подсушивается, нарезается кусочками (2х4 см) и сохраняется в темных склянках с притертой пробкой. Срок хранения неограниченный.
Примечание. Свежеприготовленные карболовые растворы красок имеют на поверхности пленку с металлическим блеском. Эти растворы стойкие и сохраняются довольно долго. Однако при слишком длительном хранении они могут стать непригодными; в этом случае металлический блеск на поверхности их пропадает, а на дне образуется мелкий порошкообразный осадок.
Микроскоп.
В этой статье расскажу 3 способа приготовления препаратов для микроскопа. Эти способы - самые простые.
В начале статьи - так называемый словарик, а точнее пояснения, что такое тот или иной предмет.
Для изготовления микропрепаратов требуется специальный инструмент, красители, а также определенная аккуратность и сноровка. Очень важно строгое соблюдение всех необходимых условий – иначе микропрепарат может оказаться непригодным для исследований.
В продаже есть готовые наборы препаратов для исследований (что удобно для дома и школы) - например, 25 препаратов , или 38 слайдов от Левенгук . А также минералы и другие наборы.
пояснения
Фиксированный препарат - в микробиологии часто готовят именно фиксированные препараты, так что следует знать, что это такое. Эти препараты рассматривают под микроскопом именно в окрашенном виде. Под словом "фиксация" имеется ввиду такая обработка живого объекта (который вы собираетесь рассмотреть), которая дает возможность быстро прервать жизненные процессы в том или ином объекте (поясню проще - убить), при этом сохранив тонкую структуру. В результате фиксации клетки прочно прикрепляются к стеклу и лучше прокрашиваются. Фиксация необходима в случае работы с патогенными микроорганизмами (в целях самобезопасности).
Суспензия - смесь каких-либо веществ, где твёрдое вещество распределено в виде мельчайших частиц в жидком веществе в неосевшем состоянии.
Биологическая петля - тонкая металлическая палочка, на конце - тонкая металлическая петля. Используется для захватывания маленького количества той или иной суспензии микроорганизмов.
Вазелин - мазеобразная жидкость без запаха и вкуса. Смесь состоит из минерального масла и твёрдых парафинов (воскоподобная смесь).
Герметизация - обеспечение совершенной непроницаемости для разных газов и жидкостей поверхностей и мест соединения деталей.
Агар-агар - в микробиологии используется для изготовления плотных и полужидких питательных сред, то есть агаризованных сред.
Жидкость Карнуа - жидкость для фиксации.
Горелка - устройство, имеющее инжектор, который установлен в металлической трубке с отверстиями для поступления в эту трубку атмосферного воздуха, которая закреплена на подставке с боковым вводом для подачи в трубку газа, при этом отверстия выполнены на боковой поверхности трубки, на которой для изменения подачи воздуха в горелку, может быть установлена подвижная заслонка, изменяющая площадь проходного сечения этих отверстий.
Смесь Никифорова - смесь равных объемов этилового спирта и безводного серного эфира, применяется для фиксации мазков крови, мазков-отпечатков органов и каких либо тканей.
Приготовления препарата "раздавленная капля"

Приготовление препарата "висячая капля"

Висячая капля.
- Одну каплю суспензии микроорганизмов (заранее приготовленной) с помощью биологической петли аккуратно нанесите на чистое покровное стекло.
- Переверните покровное стекло с каплей суспензии так, чтобы капля свободно висела.
- Поместите перевёрнутое покровное стекло с каплей над лункой специального покровного стекла с углублением в центре.
- Капля не должна касаться краёв стекла и углубления (лунки), она должна свободно висеть на покровном стекле.
- Края углубления специального покровного стекла предварительно смазывают вазелином для герметизации камеры.
- Наслаждайтесь наблюдением за бактериями в микропрепарате!
Приготовление препарата "отпечаток"
- Препарат готов!
- Внимание! Препараты живых клеток рассматривают с помощью "сухих систем" микроскопа. После микроскопирования такие препараты перед мытьем должны быть выдержаны в дезрастворе (дезинфицирующее средство).
Из агаризованной среды, на которой какие-либо микроорганизмы растут абсолютным сплошным газоном или же в виде отдельных колоний, аккуратно вырежете скальпелем не очень большой кубик.
Перенесите его на предметное стекло таким образом, чтобы поверхность кубика с микроорганизмами была обращена именно вверх.
Затем к газону микроорганизмов или к колонии приложите обычное покровное стекло (абсолютно чистое), аккуратно и не сильно, а слегка, надавите на него биологической петлей или пинцетом и тотчас снимите, стараясь не сдвинуть его в сторону.
Полученный препарат (покровное стекло с отпечатком) помещают именно отпечатком вниз в каплю обычной воды на чистое предметное стекло. Отпечаток также можно получить и на предметном стекле, если касаться поверхности колонии предметным стеклом.
Приготовление препарата "отпечаток", иной способ

Приготовление препарата "фиксированный мазок"
- Готово!
Для того, чтобы приготовить этот препарат, требуется на обезжиренное предметное стекло нанести одну каплю воды.
В неё биологической петлей внесите исследуемый вами материал и распределите его так, чтобы получить тонкий и равномерный мазок диаметром примерно 1-1,5 сантиметра (только при таком распределении материала в мазке можно увидеть изолированные бактериальные клетки).
Если исследуемый материал содержится в жидкой среде, то петлей его непосредственно наносят на предметное стекло и готовят мазок. Мазки высушивают на воздухе или в струе теплого воздуха над пламенем горелки.
Для фиксации мазка предметное стекло (именно мазком вверх) очень аккуратно и медленно проводят 3 раза (в течение всего 3 секунд) через пламя горелки. Микроорганизмы, находящиеся в мазке, при фиксации погибают, плотно прикрепляясь к поверхности предметного стекла, и они не смываются при дальнейшей обработке препарата.
Внимание! Более долгое нагревание может вызвать деформацию структур клеток. Мазки крови, мазки-отпечатки органов и каких-либо тканей и (в некоторых случаях и мазки из культур), фиксируют погружением на 5-20 минут в метиловый синий или этиловый спирт, смесь Никифорова, также сулемовый спирт или иные фиксирующие жидкости.
Примеры микропрепаратов для микроскопа
Ботаника и зоология:
Кожица лука
Зерновка ржи
Корневой чехлик
Ветка липы
Пыльник
Завязь
Камелия
Эпидермис листа герани
Конечность пчелы
Крыло пчелы
Циклоп
Вольвокс
Эвглена
Инфузория-туфелька
Дождевой червь (поперечный срез)
Ротовой аппарат комара
Аскарида
Дафнии
Биология и физиология:
Мутация дрозофилы (бескрылая форма)
Мутация дрозофилы (черное тело)
Дрозофила "норма"
Животная клетка
Растительная клетка
Плесень мукор
Дробление яйцеклетки
Митоз в корешке лука
Поперечно-полосатые мышцы
Сперматазоиды млекопитающего
Нерв (поперечный срез)
Рыхлая соединительная ткань
Яйцеклетка млекопитающего
Нервные клетки
Гиалиновый хрящ
Гладкие мышцы
Костная ткань
Кровь лягушки
Кровь человека
Однослойный эпителий
При покупке микроскопа стоит задуматься о приобретении дополнительных аксессуаров. Предметные и покровные стекла, пипетка, острый нож и иммерсионное масло - вот основные составляющие необходимого набора. Но не менее важны и микропрепараты. Особенно если прибор предназначается для ребенка. В наборе микропрепаратов находятся полностью подготовленные образцы материалов для исследования. Их очень удобно применять и легко устанавливать на предметный столик. Но когда все представленные предметы будут изучены, исследования становятся скучными, поэтому мы советуем готовить микропрепараты самостоятельно.
Легко можно получить временный
микропрепарат, срезав кожицу лука или добыв каплю крови.
Сроки хранения таких образцов невелики, поэтому нужно
научиться "консервировать" их. Для этих целей используется
«канадский» бальзам, глицерин с желатином или целлоидин.
Одно из этих веществ наносится на покровное стекло и
склеивается с предметным.
Чтобы изучать жизнь простейших в капле воды, необходимо ее
разместить в стекле с выемкой, обработав его предварительно
кипящим содовым раствором (на 1 литр воды чайная ложка
соды), кипятить необходимо не менее 15 минут. Стеклышко
вытереть досуха, затем пипеткой поместить туда коплю воды из
водоема или аквариума и волокна ваты, чтобы утруднить
движение простейших. Покровное стекло предварительно нужно
обработать парафином либо вазелином, а потом наложить его на
предметное.
Можно взять и обычное стекло, без углубления. Обработать его пчелиным воском, в центр положить несколько волокон ваты, каплю воды и все плотно покрыть стеклом, не допуская попадания воздуха. Получится эффект "раздавленной капли". И в первом, и во втором случае образуется воздухонепроницаемое приспособление, в котором жидкость долго не будет испаряться.
Для более детального изучения микропрепараты допускается окрасить, при этом необходимо выбирать специальные нетоксичные красители. Достоверные результаты дают нейтральный красный в соотношении не более 1 к 200 000 и неконцентрированный щелочной раствор конго красного.
Во время исследования жизнедеятельности простейших в микропрепаратах важным фактором остается освещение. Оно должно быть специфическим. Поле зрения необходимо затемнять. Прямой луч света не позволяет рассмотреть все важные детали. Исследование стоит начинать с настройки микроскопа в режиме малого увеличения при суженной диафрагме. Затем, манипулируя объективом и фокусировочным механизмом, увеличивать картинку.
Но простое увеличение микропрепаратов с помощью объектива не всегда дает полную информацию об образце. В таком случае необходимо применять специальное иммерсионное масло. Оно значительно повышает разрешающую способность линзы.
Различают несколько видов иммерсии. Черным кольцом на объективе обозначается масляная, белым - водная, глицериновая - желтым, монобромнафталиновая иммерсия – красным. Масляная и водная импрессии наиболее распространенные, обычно применяются при проведении опытов по биологии. В итоге получаются наиболее достоверные результаты. После применения масел объектив необходимо протереть лоскутком специальной батистовой ткани, смоченной в специальное вещество для чистки объективов. Остальные виды объективов протирать запрещается!
Касторовое, вазелиновое, оливковое масло не стоит применять для увеличения разрешения. Эффективными являются исключительно иммерсионные. Благодаря их высокой величине преломления появляется возможность рассмотреть мельчайшие детали. Некачественные масла могут повредить линзу.
Для изготовления постоянного
микропрепарата хорошо подходит глицерин-желатин. Вот как
можно его приготовить. Замочить на сутки 10 г желатина в
воде. Затем переместить его на водяную баню и, равномерно
помешивая, ввести в него 15 г глицерина и карболовую кислоту
или формалин (2-3 капли). Процедить полученную смесь и
закрыть в герметичный сосуд. При необходимости раствор
разогревают и заливают им обработанные спиртом
микропрепараты, срок хранения которых после этого может
составлять несколько лет.
Овладев техникой создания микропрепаратов препаратов, можно
создавать собственные коллекции образцов.
Для тех, кто только начинает познавать микромир, мы рекомендуем приобрести уже готовый набор микропрепаратов Альтами, который включает в себя 40 образцов растительного и животного миров. Среди всего остального, в нем вы найдете самые популярные микропрепараты: кожицу лука, срез ветки липы, плесень, срезы органов, кровяных сосудов, костные клетки человека и животных, частички различных насекомых. Такое богатство самому раздобыть очень непросто, а иногда и невозможно.
Научившись изготавливать микропрепараты самостоятельно, вы сможете успешно пополнять набор Альтами новыми образцами.