Снижающие тонус скелетной мускулатуры с уменьшением двигательной активности вплоть до полного обездвиживания.
Энциклопедичный YouTube
1 / 3
Базисная фармакология миорелаксантов периферического действия
Миорелаксанты | Блокада триггерных точек | Trigger Point Injection
Холиноблокаторы. М и Н-холиноблокаторы.
Субтитры
Общая характеристика
Механизм действия - блокада Н-холинорецепторов в синапсах прекращает подачу нервного импульса к скелетным мышцам, и мышцы перестают сокращаться. Расслабление идет снизу вверх, от кончиков пальцев ног до мимических мышц. Последней расслабляется диафрагма . Восстановление проводимости идет в обратном порядке. Первым субъективным признаком окончания миорелаксации являются попытки пациента дышать самостоятельно. Признаки полной декураризации: пациент может поднять и удержать голову в течение 5 секунд, крепко сжать руку и дышать самостоятельно на протяжении 10-15 минут без признаков гипоксии .
Объективно степень воздействия миорелаксантов определяют с помощью таких методов: электромиография , акцеломиография, периферическая нейростимуляция, механомиография.
Время действия миорелаксантов удлиняется при наличии таких факторов: гипотония , гипоксия , гиперкапния , метаболический ацидоз , гиповолемия , нарушение микроциркуляции, гипокалиемия , глубокий наркоз, гипотермия , пожилой возраст пациента.
Общие показания к применению миорелаксантов
2. Обеспечение миорелаксации во время оперативных вмешательств для создания оптимальных условий работы хирургической бригады без избыточных доз препаратов для общей анестезии, а также необходимость мышечного расслабления при некоторых диагностических манипуляциях, выполняемых в условиях общей анестезии (например, бронхоскопия).
3. Подавление самостоятельного дыхания с целью проведения ИВЛ .
4. Устранение судорожного синдрома при неэффективности противосудорожных препаратов.
5. Блокада защитных реакций на холод в виде мышечной дрожи и гипертонуса мышц при искусственной гипотермии.
6. Миорелаксация при репозиции отломков костей и вправлении вывихов в суставах, где имеются мощные мышечные массивы.
Общие противопоказания к применению миорелаксантов
4. Повышение давления внутри полых органов и полостей организма.
5. Выброс калия в кровь может привести к гиперкалиемии , а та в свою очередь к брадикардии и остановке сердца .
Противопоказания:
1. Пациенты с исходной гиперкалиемией (почечная недостаточность, обширные ожоги и травмы мышц).
2. Пациенты с нарушением сердечного ритма.
3. Пациенты с риском осложнений при повышении ВЧД , повышении давления в полых органах ЖКТ . Пациенты с глаукомой .
Препараты:
На данный момент из-за возможных осложнений в клинике используется только листенон , но и он постепенно заменяется недеполяризирующими миорелаксантами короткого действия.
Недеполяризирующие миорелаксанты - блокируют рецепторы и мембранные каналы без их открытия, не вызывая деполяризацию. Продолжительность действия и свойства зависят от препарата.
Антихолинэстеразные препараты блокируют холинэстеразу, количество ацетилхолина увеличивается и он конкурентно вытесняет недеполяризирующий миорелаксант. Используется прозерин в дозе 0,03-0,05 мг/кг массы тела. За 2-3 минуты перед применением для нивелирования побочных эффектов прозерина вводится атропин 0,1% 0,5 мл. внутривенно. Декураризация противопоказана при глубоком мышечном блоке и любом нарушении водно-электролитного баланса. Если действие прозерина кончается раньше, чем действие миорелаксанта, то может произойти рекураризация - возобновление миорелаксации из-за активации холинэстеразы и уменьшения количества ацетилхолина в синаптической щели.
Средства, блокирующие нервно-мышечные синапсы, вызывают расслабление скелетных мышц (миорелаксацию) вследствие блокады передачи нервных импульсов с двигательных нервов на мышцы.
В зависимости от механизма нервно-мышечного блока выделяют
Миорелаксанты антидеполяризующего (недеполяризующего) действия
Миорелаксанты деполяризующего действия.
Миорелаксанты антидеполяризующего (недеполяризующего) действия.
Вещества этой группы блокируют Н-холинорецепторы, локализованные на концевой пластинке скелетных мышц, и препятствуют их взаимодействию с аце-тилхолином, в результате чего ацетилхолин не вызывает деполяризацию мембраны мышечных волокон - мышцы не сокращаются. Такое состояние называется нервно-мышечным блоком. Однако при повышении концентрации ацетилхоли-на в синаптической щели (например, при применении антихолинэстеразных
средств) ацетилхолин конкурентно вытесняет миорелаксант из связи с Н-холи-норецептором и вызывает деполяризацию постсинаптической мембраны - происходит восстановление нервно-мышечной передачи. Вещества, действующие подобным образом, называются миорелаксантами антидеполяризующего конкурентного действия.
Антидеполяризующие миорелаксанты в основном относятся к двум химическим группам:
Бензилизохинолины (тубокурарин, атракурий, мивакурий);
Аминостероиды (пипекуроний, векуроний, рокуроний).
В зависимости от продолжительности вызываемого ими нервно-мышечного блока выделяют препараты:
Длительного действия (30 мин и более) - тубокурарин, пипекуроний;
Средней продолжительности действия (20-30 мин) - атракурий, векуроний, рокуроний;
Короткого действия (10 мин) - мивакурий.
Курареподобные средства используются для расслабления скелетных мышц при хирургических операциях. Под действием курареподобных средств мышцы расслабляются в следующей последовательности: сначала мышцы лица, гортани, шеи, затем мышцы конечностей, туловища и в последнюю очередь дыхательные мышцы - наступает остановка дыхания. При выключении дыхания больного переводят на искусственную вентиляцию легких.
Кроме того, курареподобные средства применяют для устранения тонических судорог при столбняке и при отравлении стрихнином. При этом расслабление скелетных мышц способствует устранению судорог.
Побочные эффекты некоторых курареподобных средств (тубокурарин, атракурий, мивакурий) связаны главным образом с их способностью высвобождать гистамин. Это может быть причиной гипотензии, бронхоспазма, покраснения кожи, а также реже - других анафилактоидных реакций. В большей степени высвобождению гистамина способствует тубокурарин.
Антагонистами миорелаксантов антидеполяризующего действия являются антихолинэстеразные средства. Угнетая активность ацетилхолинэстеразы, они предотвращают гидролиз ацетилхолина и таким образом увеличивают его концентрацию в синаптической щели. Ацетилхолин вытесняет препарат из связи с Н-холинорецепторами, что приводит к восстановлению нервно-мышечной передачи. Антихолинэстеразные средства (в частности, неостигмин) применяют для прерывания нервно-мышечного блока или устранения остаточных явлений после введения антидеполяризующих мышечных релаксантов.
Миорелаксанты деполяризующего действия.
Суксаметоний вызывает стойкую деполяризацию постсинаптической мембраны концевой пластинки. Это приводит к нарушению нервно-мышечной
передачи и расслаблению скелетных мышц. При этом выделяющийся в синапти-ческую щель ацетилхолин лишь усиливает деполяризацию мембраны и углубляет нервно-мышечный блок.
Суксаметоний применяется при интубации трахеи, эндоскопических процедурах (бронхо-, эзофаго-, цистоскопии), кратковременных операциях (наложение швов на брюшную стенку, вправление вывихов, репозиция костных отломков), для устранения тонических судорог при столбняке.
После внутривенного введения суксаметония его миопаралитическое действие начинается через 30 с-1 мин, и продолжается до 10 мин. Такое кратковременное действие препарата связано с его быстрым разрушением псевдохолинэстеразой плазмы крови (образуются холин и янтарная кислота). При генетической недостаточности этого фермента действие суксаметония может продолжаться до 2-6 ч. Миорелаксирующее действие препарата можно прекратить переливанием свежей цитратной крови, которая содержит активную псевдохолинэстеразу.
Побочные эффекты: послеоперационные мышечные боли (что связывают с микротравмами мышц во время их фасцикуляций), угнетение дыхания (апноэ), гиперкалиемия и аритмии сердца, гипертензия, повышение внутриглазного давления, рабдомиолиз и миоглобинемия, гипертермия. Суксаметоний противопоказан при глаукоме, нарушении функции печени, анемии, беременности, злокачественной гипертермии, в грудном возрасте.
Адреномиметические средства. Классификация. Влияние адреналина на сердечно-сосудистую систему, гладкую мускулатуру, обмен веществ. Норадреналин и другие адреномиметики. Показания к применению.
Адреномиметики подразделяют на:
а) α-адреномиметики (средства, преимущественно стимулирующие α-адренорецепторы);
Мезатон (а,) Нафтизин (а 2)
Галазолин (а 2)
б) β-адреномиметики (средства, преимущественно стимулирующие β-адренорецепторы);
Изадрин (b1, b2)
Добутамин (b1)
Сальбутамол (b2)
Фенотерол (b2)
Тербуталин (b2)
в) а-, β- адреномиметики (средства, стимулирующие α- и β-адренорецепторы).
Адреналина гидрохлорид (или гидротартрат)
Норадреналина гидротартрат
Стимулируя b-адренорецепторы сердца, адреналин увеличивает силу и частоту сердечных сокращений и в связи с этим ударный и минутный объем сердца. При этом увеличивается потребление миокардом кислорода. Систолическое артериальное давление повышается. Прессорная реакция обычно вызывает рефлекторную брадикардию.
Адреналин расширяет зрачки (за счет сокращения радиальной мышцы радужной оболочки глаза
Выраженное влияние оказывает адреналин на гладкие мышцы внутренних органов. Стимулируя р-адренорецепторы бронхов, он расслабляет гладкие мышцы последних и устраняет бронхоспазм. Тонус и моторика желудочно-кишечного тракта под влиянием адреналина снижаются (за счет возбуждения а- и р-адренорецепторов), сфинктеры тонизируются (стимулируются а-адренорецепторы). Сфинктер мочевого пузыря также сокращается.
При введении адреналина сокращается капсула селезенки.
Он оказывает благоприятное влияние на нервно-мышечную передачу, особенно на фоне утомления мышц. Это связывают с повышением выделения из преси-наптических окончаний ацетилхолина, а также с прямым действием адреналина на мышцу.
Секрецию слюнных желез адреналин увеличивает (выделяется густая, вязкая слюна).
Для адреналина характерно влияние на обмен веществ. Он стимулирует гли-когенолиз (возникает гипергликемия, в крови увеличиваются содержание молочной кислоты и ионов калия) и липолиз (увеличение в плазме крови содержания свободных жирных кислот за счет выхода из жировых депо).
При воздействии адреналина на ЦНС преобладают эффекты возбуждения. Выражено это в небольшой степени.
При введении внутрь адреналин разрушается (в желудочно-кишечном тракте и печени). В связи с этим его применяют парентерально (подкожно, внутримышечно, а иногда внутривенно) и местно. Действует адреналин кратковременно (при внутривенном введении - около 5 мин, при подкожном - до 30 мин), так как происходят его быстрый нейрональный захват, а также ферментативное расщепление при участии КОМТ и отчасти МАО.
Применяют адреналин при анафилактическом шоке и некоторых других аллергических реакциях немедленного типа. Он эффективен также как бронхоли-тик для купирования приступов бронхиальной астмы. Применяют его и при гипогликемической коме, вызванной противодиабетическими средствами (инсулином и др.). Иногда его назначают в качестве прессорного вещества (для этих целей чаще используют норадреналин и мезатон). Адреналин добавляют в растворы анестетиков (см. главу I; 1.1). Сужение сосудов в области введения адреналина усиливает местную анестезию и уменьшает резорбтивное и возможное токсическое действие анестетиков. Адреналин может быть использован для устранения атриовентрикулярного блока, а также в случае остановки сердца (вводят интра-кардиально). Он находит применение в офтальмологии для расширения зрачка и при открытоугольной форме глаукомы.
Адреналин может приводить к нарушениям сердечного ритма. Наиболее выражены аритмии (в частности, желудочковые экстрасистолы) при введении адреналина с веществами, сенсибилизирующими к нему миокард (например, на фоне действия средства для наркоза фторотана).
НОРАДРЕНАЛИН.
Основным эффектом норадреналина является выраженное, но непродолжительное (в течение нескольких минут) повышение артериального давления, связанное с его влиянием на а-адренорецепторы сосудов и повышением периферического сопротивления последних. В отличие от адреналина последующего снижения артериального давления обычно не наблюдается, так как норадреналин очень мало влияет на В 2 -адренорецепторы сосудов. Вены под влиянием норадреналина суживаются.
Ритм сердечных сокращений на фоне действия норадреналина урежается. Синусовая брадикардия возникает в результате рефлекторных влияний с механоре-пепторов сосудов в ответ на быстро наступающую гипертензию. Эфферентными путями являются блуждающие нервы. В связи с этим брадикардию на норадреналин можно предупредить путем введения атропина. Рефлекторные механизмы в значительной степени нивелируют стимулирующее влияние норадреналина на Р,-адренорецепторы сердца. В итоге сердечный выброс (минутный объем) практически не изменяется или даже снижается, а ударный объем возрастает.
На гладкие мышцы внутренних органов, обмен веществ и ЦНС норадреналин оказывает однонаправленное с адреналином влияние, но по выраженности этих эффектов существенно уступает ему.
При введении внутрь норадреналин разрушается (в желудочно-кишечном тракте и печени). При подкожном введении вызывает спазм сосудов на месте инъекции и поэтому плохо всасывается и может вызвать некроз ткани. Основным является внутривенный путь его введения. После однократной инъекции норадреналин действует кратковременно, поэтому его вводят в вену капельно. Скорость внутривенной инфузии определяется повышением артериального давления до требуемого уровня. В организме норадреналин быстро инактивируется за счет уже отмеченных механизмов (нейрональный захват, энзиматические превращения). Метаболиты и незначительная часть неизмененного норадреналина выводятся почками.
Применяют норадреналин при многих состояниях, сопровождающихся острым снижением артериального давления (травмы, хирургические вмешательства).
При кардиогенном и геморрагическом шоке с выраженной гипотензией норадреналин применять не рекомендуют, так как вызываемый им спазм артериол еще больше ухудшает кровоснабжение тканей. В этих случаях положительный эффект могут дать а-адреноблокаторы и, возможно, р-адреномиметики; для повышения артериального давления используют кровезаменители.
Побочные эффекты при применении норадреналина наблюдаются редко. Возможны нарушения дыхания, головная боль, аритмии сердца при сочетании с веществами, повышающими возбудимость миокарда. Следует учитывать возможность некроза ткани на месте введения норадреналина. Это связано с попаданием последнего в окружающие ткани и спазмом артериол. Введение норадреналина в вену через катетер, использование грелок, смена мест введения и другие мероприятия уменьшают возможность такого осложнения.
Из деполяризующих миорелаксантов, применяющихся сегодня в клинической практике, используется сукцинилхолин (суксаметониум хлорид, листенон) .
Сукцинилхолин (СХ) является четвертичным аммониевым соединением, представляющим собой две молекулы АХ, соединенные вместе. Два четвертичных аммониевых радикала N + (CH 3) 3 способны связываться с каждой из α-субъединиц постсинаптического АХ-рецептора, изменяя его структурное строение и открывая ионный канал на более длительный период, чем это отмечается при воздействии молекулы АХ. Таким образом, введение СХ вначале приводит к деполяризации и мышечному сокращению, известному как фасцикуляция . Но поскольку этот эффект сохраняется дольше обычного, последующие потенциалы действия не могут пройти через ионные каналы и мышца расслабляется; реполяризация в этом случае наступает спонтанно вследствие блокады последующих потенциалов действия.
Доза СХ, которая требуется для интубации трахеи у взрослого, составляет примерно 1,5–2,0 мг/кг. Такая доза обеспечивает быстрое начало действия, а также развитие глубокого блока в течение 1 мин. Анестезиологи Европы и США отказались от повседневного использования СХ
из-за его побочных эффектов. Однако СХ является препаратом выбора
в тех случаях, когда необходима быстрая интубация трахеи, например,
у пациента с полным желудком или в акушерской практике. Он также показан в случаях предполагаемой трудной интубации (вследствие анатомических причин), поскольку обеспечивает оптимальные условия для ее выполнения.
Препарат очень быстро метаболизируется плазменной холинэстеразой (псевдохолинэстеразой). Восстановление после нейромышечного блока начинается через 3 мин и полностью завершается в течение 12–15 мин. Применение антихолинэстеразных препаратов с целью продления нейромышечного блока при использовании СХ противопоказано. Ингибиторы холинэстеразы значительно удлиняют I фазу деполяризующего блока . Это объясняют следующим образом:
· во-первых, угнетение ацетилхолинэстеразы приводит к повышению концентрации АХ в нервном окончании, что дополнительно стимулирует деполяризацию;
· во-вторых, антихолинэстеразные препараты угнетают активность псевдохолинэстеразы, замедляя, таким образом, гидролиз СХ. Некоторые антихолинэстеразные соединения, например фосфорорганические, способны продлить действие СХ на 20–30 мин.
Пояснение: После начального возбуждения под влиянием СХ натриевые каналы закрываются и не могут снова открываться, пока не произойдет реполяризация концевой пластинки. Однако реполяризация невозможна, пока миорелаксант связан с холинорецепторами. Поскольку натриевые каналы в области синапса остаются закрытыми, потенциал действия истощается и мембрана мышечной клетки реполяризуется, что и приводит к миорелаксации. Такую блокаду нервно-мышечной проводимости принято называть I фазой деполяризующего блока . При чрезмерно высокой дозе деполяризующего миорелаксанта нервно-мышечный блок начинает напоминать недеполяризующий. Этот феномен получил название II фазы деполяризующего блока .
Первичный метаболит СХ (сукцинилмонохолин) обладает значительно более слабым нейромышечным блоком и очень медленно расщепляется до сукциниловой кислоты и холина. Около 10 % СХ выводится с мочой; его метаболизм в печени очень незначителен, а вот в плазме разрушение сукцинилхолина происходит также под влиянием других ферментов (неспецифических эстераз). Нужно отметить, что псевдохолинэстераза (ПХЭ) имеет огромную способность к гидролизу СХ, причем с высокой скоростью; вследствие этого только небольшая фракция исходной внутривенной дозы СХ достигает нейромышечного окончания и оказывает миорелаксирующее действие. При структурно аномальной плазменной холинэстеразе, что может быть обусловлено наследственными факторами, или при снижении ее уровня в плазме длительность действия СХ может значительно и непредсказуемо увеличиться.
Наследственные факторы холинэстеразной недостаточности. Точная структура плазменной холинэстеразы в настоящее время установлена полностью. Известно, что она определяется генетически (аутосомными генами). Выявлен ряд наследственных аномалий в аминокислотной последовательности холинэстеразы. Эти аномалии обозначаются как Е u 1 . Наиболее часто встречается отклонение, вызванное атипичным геном Е а 1 , имеющимся примерно у 4 % европейцев. У пациента, гетерозиготного по атипичному гену (Е u 1 , Е а 1), действие стандартной дозы СХ может длиться 30 мин, а у лиц, гомозиготных по атипичному гену (Е а 1 , Е а 1), длительность действия СХ иногда превышает 2 часа. У пациентов с атипичной холинэстеразой, обусловленной генетическими аномалиями, постепенный клиренс препарата из плазмы осуществляется неспецифическими эстеразами. В подобных случаях предлагалось вводить свежезамороженную плазму, как источник холинэстеразы, или применять для реверсии нейромышечного блока антихолинэстеразные препараты, к примеру неостигмин, однако вещества с антихолинэстеразной активностью в данном случае приводят к развитию двойного блока. Чтобы выйти из этой ситуации, следует:
· тщательно контролировать нейромышечную передачу вплоть до полного исчезновения признаков остаточной миорелаксации.
Удлинение нейромышечной блокады вследствие дефекта холинэстеразы не является угрожающим состоянием, однако риск осведомленности пациента о развитии такой клинической ситуации достаточно велик, особенно после окончания операции, когда анестезиолог, еще не имеющий какой-либо информации о пролонгировании нейромышечного блока, пытается разбудить больного. Поэтому еще раз следует напомнить, что анестезия и ИВЛ должны продолжаться до полного восстановления нейромышечной проводимости .
Пациент, у которого обнаружено снижение активности холинэстеразы или выявлена аномальная структура этого фермента, должен быть информирован об этом. Кроме того, в медицинской документации (история болезни, выписка из нее) необходимо сделать соответствующую запись, а также поставить в известность ближайших родственников пациента.
В 1957 г. Kalow и Genest впервые предложили метод определения структурно аномальной холинэстеразы. Если плазму пациента с нормальным генотипом поместить на водяную баню и добавить к ней бензоилхолин, то вследствие химической реакции с плазменной холинэстеразой будет излучаться свет с определенной длиной волны. Это излучение можно определить спектрофотометром. Если же к плазме добавить еще и дибукаин, то произойдет ингибирование реакции бензоилхолина с холинэстеразой и излучение наблюдаться не будет. Относительный процент ингибирования называется дибукаиновым числом . Пациенты с нормальной холинэстеразой имеют высокое дибукаиновое число (от 77 до 83). У пациентов, гетерозиготных по атипичному гену, это число составляет 45–68, а у гомозиготных - менее 30.
Приобретенные факторы холинэстеразной недостаточности. Приобретенные факторы увеличивают продолжительность нейромышечного блока не столь выраженно, как генетические аномалии. Речь в данном случае идет скорее не о часах, а о минутах. Нужно отметить, что в этих случаях плазменная холинэстераза, как правило, структурно нормальная, и наблюдается лишь снижение ее активности или концентрации под влиянием определенных причин. К ним относятся:
· заболевания печени (снижен синтез фермента);
· онкозаболевания с признаками метастазирования, голодание, ожоги (снижен синтез фермента);
· беременность: увеличение циркулирующего объема крови (эффект разведения) и понижение синтеза фермента;
· антихолинэстеразные препараты (неостигмин, эдрофониум, экотиопат);
· препараты, метаболизирующиеся плазменной холинэстеразой и снижающие тем самым ее доступность (этомидат, местные анальгетики эфирной группы, метотрексат, ингибиторы МАО, β-блокатор короткого действия эсмолол);
· другие лекарственные препараты (метоклопрамид, гексафлуорениум);
· гипотиреоидизм ;
· искусственное кровообращение, плазмаферез ;
· заболевания почек с проявлением их дисфункции.
Существует мнение, что препараты, влияющие на продолжительность действия СХ, могут оказывать подобный эффект и в отношении недеполяризующего миорелаксанта мивакурия , а также гидролизирующегося ПХЭ.
Побочные эффекты СХ. Хотя СХ достаточно широко применяется в стационарах Республики Беларусь, он имеет ряд побочных эффектов, которые ограничивают его применение. Наиболее важными среди них являются:
1. Мышечные боли. Причиной их, очевидно, являются фасцикуляции в начале действия препарата. Наиболее часто боли наблюдаются у молодых пациентов с хорошей мышечной массой. Боль возникает в таких необычных местах, как межлопаточная область, диафрагма и плохо устраняется обычными анальгетиками. Она может быть уменьшена с помощью небольшой дозы недеполяризующего мышечного релаксанта, введенного перед применением СХ (прекураризация ), например, 1–2 мг панкурония или 2,5–5 мг атракуриума. Однако этот метод снижает мощность СХ, что требует введения более высокой дозы препарата для получения такого же эффекта (данный тезис спорный и не всегда подтверждается в ходе мониторинга нервно-мышечной блокады).
2. Повышение внутриглазного давления. Предполагалось, что повышение внутриглазного давления отчасти обусловлено сокращением наружных глазных мышц при введении СХ (фасцикуляции), однако оказалось, что проведение прекураризации не предупреждает развитие этого побочного эффекта. Более того, он сохраняется на всем протяжении нейромышечного блока. Существует также предположение, что СХ может повышать и внутричерепное давление.
3. Повышение внутрижелудочного давления. При нормальной функции пищеводного сфинктера повышение внутрижелудочного давления, обусловленное действием СХ, обычно бывает недостаточным для регургитации желудочного содержимого. Однако у больных с недостаточностью этого сфинктера, например при грыже пищеводного отверстия диафрагмы, регургитация вполне возможна.
4. Гиперкалиемия. В 1959 г. Paton установил, что при анестезии галотаном введение СХ приводит к повышению содержания сывороточного калия на 0,5 ммоль/л. Полагают, что данный эффект обусловлен мышечной фасцикуляцией. Аналогичный подъем уровня калия наблюдается у пациентов с почечной недостаточностью, причем исходно высокий уровень калия после введения СХ вследствие дополнительного прироста его концентрации может привести к тяжелым нарушениям сердечного ритма и проводимости вплоть до остановки сердца. При некоторых патологических состояниях, сопровождающихся отеком мышечной ткани или ее повреждением, выброс калия может быть еще более существенным. Это наиболее заметно у больных с ожогами, когда после введения СХ уровень калия в плазме может достигать 10 ммоль/л и выше. Прекураризация у таких пациентов бесполезна и в данном случае лучше избегать применения СХ. Гиперкалиемия при использовании СХ может возникать и при заболеваниях мышечных клеток или нарушении их иннервации: мышечная дистрофия, миотоническая дистрофия и параплегия. Описаны случаи смерти таких больных вследствие гиперкалиемии. Применение СХ не показано во всех случаях нейромышечных расстройств.
5. Введение деполяризующих релаксантов может провоцировать проявление синдрома злокачественной гипертермии .
6. Кардиоваскулярные расстройства. СХ, также как и АХ, обладает мускарино- и никотиноподобным эффектами. Прямой вагостимулирующий (мускариноподобный) эффект сопровождается синусовой брадикардией, особенно у пациентов с высоким тонусом блуждающего нерва (дети и физически крепкие люди). Чаще всего это наблюдается в ситуациях, когда премедикация проводится без атропина, а также после введения повторных доз препарата. Наиболее выраженным проявлением кардиоваскулярных расстройств, обусловленных СХ, является узловая или желудочковая экстрасистолия.
7. Существенным недостатком является наличие высокого гистаминолиберирующего эффекта .
| Недеполяризующие мышечные релаксанты Недеполяризующие миорелаксанты, в отличие от деполяризующих, не изменяют структурной конформации постсинаптических АХ-рецеп-торов и, таким образом, не вызывают мышечных фасцикуляций после первого введения. Они являются конкурентами АХ, обратимо связываясь с одной или двумя свободными α-субъединицами рецептора (т. е. конкурентный антагонизм). Вследствие этого потенциал концевой пластинки нейромышечного соединения не достигает порогового уровня, при котором наступает инициация потенциала действия и активация сарколеммы. В результате мышечного сокращения не наблюдается. Для того, чтобы мышечные сокращения стали невозможными, необходимо, чтобы 75 % постсинаптических рецепторов были заблокированы недеполяризующим миорелаксантом. Следует отметить, что клинический эффект при использовании препаратов этой группы является дозозависимым: в больших дозах недеполяризующие миорелаксанты существенно нарушают нейромышечную передачу и вызывают глубокий нейромышечный блок. Недеполяризующие миорелаксанты (за исключением мивакуриума) не гидролизуются ни ацетилхолинэстеразой, ни ПХЭ. Прекращение их действия происходит за счет снижения уровня препарата в зоне концевой пластинки вследствие его диффузии обратно в плазму по градиенту концентрации. Введение антихолинэстеразных препаратов ускоряет диффузию миорелаксанта в плазму и, соответственно, облегчает восстановление нейромышечной проводимости. Недеполяризующие миорелаксанты имеют следующие характерные особенности: 1. Вызывают наступление нейромышечной блокады в течение 1–5 мин (в зависимости от вида препарата и его дозы), что значительно медленнее по сравнению с деполяризующими препаратами. 2. Длительность нейромышечной блокады в зависимости от вида препарата составляет от 15 до 60 мин. 3. Введение недеполяризующих релаксантов не сопровождается мышечными фибрилляциями. 4. Окончание нейромышечного блока с его полным восстановлением может быть ускорено с помощью введения антихолинэстеразных препаратов, хотя при этом остается опасность рекураризации. 5. Одним из недостатков препаратов этой группы является кумулирование. Наименее выражен данный эффект у тракриума, нимбекса и рокурониума. 6. Также к недостаткам относится зависимость характеристик нейромышечного блока от функции печени и почек. У больных с нарушением функций этих органов длительность блока и, особенно, восстановление могут значительно увеличиваться. Для характеристики нейромышечного блока используются такие показатели как начало действия препарата (время от окончания введения до наступления полного блока), длительность действия (длительность полного блока) и период восстановления (время до восстановления 75 % проводимости). Точная оценка приведенных показателей проводится на основании миографического исследования с электростимуляцией. Разделение это достаточно условно и к тому же в значительной степени зависит от дозы релаксанта. Клинически важно то, что начало действия - это время, через которое может быть проведена интубация трахеи в комфортных условиях; длительность блока - это время, через которое требуется повторное введение миорелаксанта для продления миоплегии; период восстановления - это время, когда может быть выполнена экстубация трахеи и больной способен к адекватному самостоятельному дыханию. По химической структуре они подразделяются на следующие группы: · бензилизохинолиновые соединения (тубокурарин, доксакурий, атракурий, цисатракурий, мивакурий); · аминостероидные соединения (панкуроний, векуроний, пипекуроний, рокуроний, рапакуроний); · фенольные эфиры(галламин); · алкалоиды(алькуроний). Миорелаксанты недеполяризующего действия отличаются друг от друга различной длительностью нейромышечного блока, что позволяет разделить их на три группы: 1. Миорелаксанты длительного действия(тубокурарин, панкуроний, галламин, алькуроний). Общим для препаратов этой группы является относительно медленное развитие максимального нейромышечного блока (от 3 до 6 мин) после введения миорелаксанта в дозе, достаточной для интубации. Восстановление судорожного ответа до 25 % от нормы при их применении наблюдается через 80–120 мин. Как правило, недеполяризующие миорелаксанты этой группы требуют последующего введения препаратов, ускоряющих реверсию нейромышечного блока. Выбор миорелаксанта длительного действия определяется в первую очередь выраженностью побочных эффектов со стороны сердечно-сосу-дистой системы. Все препараты этой группы подвергаются крайне незначительным метаболическим превращениям или не метаболизируются вовсе и экскретируются главным образом через почки в неизмененном виде. 2. Миорелаксанты промежуточного (среднего) действия (векуроний, рокуроний, атракурий, цисатракурий). Начало нейромышечного блока после введения препаратов этой группы в интубационной дозе - 2 ED95 (эффективные дозы, необходимые для индукции 95 % нейромышечного блока) - наступает через 2–2,5 мин. Чтобы обеспечить адекватные условия для интубации трахеи, необходимо введение миорелаксантов в дозах, равных примерно 2 ED95. Длительность клинического эффекта - 30–60 мин, а 95 % восстановление ответа на стимуляцию наступает через 45–90 мин. У векурония и рокурония средняя продолжительность действия обусловлена наличием двух альтернативных путей элиминации из организма (печень и почки); у атракурия и цисатракурия эта особенность обусловлена тем, что они элиминируются из организма путем хофманновской деградации (при температуре 37 °С происходит спонтанное разрушение молекулы препарата с уменьшением эффекта релаксации). 3. Миорелаксанты короткого действия(мивакурий и рапакуроний). Эффект после введения мивакурия наступает примерно через 2 мин, а начало действия рапакурония - через 1 мин. Длительность клинического действия у мивакурия составляет 12–20 мин, а 95 % восстановление судорожного ответа наблюдается на 25–35 минуте. Все перечисленные соединения имеют по крайней мере одну четвертичную аммониевую группу N + (CH 3) 3 для связывания с α-субъединицами на постсинаптическом АХ-рецепторе. Структура молекулы препарата в значительной степени определяет многие его химические свойства. Так, некоторые бензилизохинолиновые соединения состоят из четвертичных аммониевых групп, связанных тонкой цепочкой метиловых групп. Благодаря такому строению они в большей степени, чем аминостероиды, способны подвергаться частичному разрушению в плазме. Кроме того, они в большей степени вызывают выброс гистамина. |
9. Отдельные группы мышечных релаксантов
11. Бензилизохинолиновые соединения
12. Тубокурарина хлорид (кураре, d-тубокурарин). Этот миорелаксант изготавливается из коры южноамериканского растения Chondrodendron tomentosum и уже использовался индейцами Южной Америки в качестве яда для стрел. Он является первым миорелаксантом, примененным в клинической практике . Показан при длительных операциях (3–4 часа), когда не ставится вопрос о ранней экстубации больного, а также в случаях, когда допустимо или желательно снижение артериального давления. Доза для интубации составляет 0,5–0,6 мг/кг. Это препарат с длительным развитием эффекта и продолжительным действием.
13. Доза тубокурарина, необходимая для проведения интубации, составляет 0,5–0,6 мг/кг, ее вводят медленно в течение 3 мин. Интраоперационная релаксация достигается нагрузочной дозой 0,15 мг/кг, что сменяется дробным введением по 0,05 мг/кг. Тубокурарин обладает выраженной способностью высвобождать гистамин , приводя к развитию гипотензии и возможному возникновению компенсаторной тахикардии. Эти эффекты могут усиливаться при применении больших доз препарата, когда начинают проявляться его ганглиоблокирующие свойства. Препарат выводится в неизмененном виде с мочой и частично с желчью. Наличие почечной недостаточности удлиняет действие препарата.
14. Бронхоспазм обусловлен высвобождением гистамина. Тубокурарин не следует использовать при бронхиальной астме.
15. Атракурия бесилат (тракриум).
Препарат разработан в Страдклайдском университете Stenlake в Великобритании и внедрен в клиническую практику в 1981 г. Stenlake установил, что четвертичные аммониевые соединения спонтанно разрушаются при различной температуре и разных величинах рН (этот феномен известен уже более 100 лет как хофмановская деградация). Многие из этих соединений обладают способностью вызывать нейромышечный блок. В поисках таких соединений, способных разлагаться при температуре и рН тела, и был синтезирован атракурий.
У здоровых пациентов наблюдается частичное выведение препарата почками (10 %), а при помощи хофмановской деградации элиминируется,
вероятно, лишь около 45 % препарата. Для ослабленных пациентов с ухудшением выделительной функции печени и почек хофмановская деградация может рассматриваться как своеобразный «страховочный пояс», поскольку и в этих условиях препарат будет выводиться из организма. Эта реакция является чисто химическим процессом, который ускоряется при сдвиге рН в щелочную сторону и при повышении температуры тела. Фактически же рН мало влияет на скорость хофмановской элиминации, а вот снижение температуры тела пациента до 34 ºС существенно замедляет деградацию препарата и удлиняет нейромышечный блок. Атракурий не вызывает столь быстрого наступления нейромышечной блокады как СХ.
16. Доза в пределах 0,3–0,6 мг/кг (в зависимости от требуемой длительности блока) обеспечивает адекватную миоплегию на 15–35 мин. Интубация трахеи может быть выполнена через 90 с после в/в инъекции тракриума в дозе 0,5–0,6 мг/кг. Полный блок может быть пролонгирован
дополнительными инъекциями тракриума в дозах 0,1–0,2 мг/кг. При этом введение дополнительных доз не сопровождается явлениями кумуляции нейромышечного блока. Спонтанное восстановление нейромышечной проводимости наступает примерно через 25–35 мин и определяется восстановлением тетанического сокращения до 95 % от исходного. Эффект действия атракурия можно быстро и надежно прекратить введением антихолинэстераз совместно с атропином.
17. Атракурий способен высвобождать гистамин в больших количествах, хотя и в 3 раза меньше, чем СХ. Это наблюдается в тех случаях, когда доза атракурия превышает 0,5 мг/кг или препарат вводится слишком быстро. При повышении уровня гистамина в плазме более 1000 пг/мл у пациента могут наблюдаться гиперемия лица и преходящее снижение артериального давления. Высвобождение гистамина может быть уменьшено путем медленного (в течение 30–60 с) введения атракурия, либо снижением дозы препарата, либо дробным введением рассчитанной дозы. Предупредить кардиоваскулярные расстройства, обусловленные высвобождением гистамина (но не выброс гистамина), можно при помощи блокаторов Н 1 - и Н 2 -гистаминовых рецепторов, например, 4 мг/кг циметидина и 1 мг/кг дифенгидрамина, введенные за 30 мин до введении атракурия способны предупредить развитие артериальной гипотензии, несмотря на 10–20-крат-ное увеличение уровня гистамина в плазме. Атракурий не обладает ваголитическим действием и не вызывает блокады аутономных ганглиев.
18. Цисатракурий (нимбекс). Этот нейромышечный блокатор введен в клиническую практику в 1996 г. Он является R-цис-R´-цисизомером атракурия (одним из 10 изомеров исходного соединения). Такая структурная конформация обусловливает повышение мощности препарата и значительное снижение числа побочных эффектов вследствие уменьшения высвобождения гистамина по сравнению с атракурием. Цисатракурий в 3–4 раза мощнее атракурия и имеет более длительное действие.
19. Доза для интубации составляет 0,1–0,15 мг/кг, ее вводят в течение
2 мин, что вызывает нервно-мышечную блокаду средней продолжительности действия (25–40 мин). Инфузия в дозе 1–2 мкг/(кг×мин) позволяет поддерживать интраоперационную миорелаксацию. Таким образом, цисатракурий равноэффективен векуронию.
20. Основное преимущество этого препарата - отсутствие высвобождения гистамина. Установлено, что даже 8-кратная ED 95 цисатракурия (в том числе и при быстром в/в введении - в течение 5 с) не вызывает увеличения содержания гистамина в плазме и изменений со стороны сердечно-сосудистой системы, поэтому препарат обеспечивает кардиоваскулярную стабильность и может применяться у лиц с отягощенным аллергологическим анамнезом. Как и атракурий, он подвергается хофмановской
деградации. Метаболитом цисатракурия является лауданозин и моночетвертичный спирт. Как следствие этой деградации, происходящей в плазме и экстрацеллюлярной жидкости, восстановление нейромышечной проводимости не зависит от дозы и длительности применения препарата. Цисатракурий не гидролизируется неспецифическими плазменными эстеразами. Примерно 23 % препарата элиминируется органозависимым путем, причем через почки выводится около 16 % от этого количества. Однако у больных ХПН не наблюдается увеличения длительности действия цисатракурия, поскольку в целом клиренс препарата у данной категории больных снижается незначительно (на 13 %). При печеночной недостаточности увеличивается объем распределения препарата, хотя фармакодинамика его при этом изменяется минимально.
21. Мивакурия хлорид . Он гидрализируется холинэстеразой плазмы на 70–88 % со скоростью гидролиза СХ. Этот путь метаболизма обеспечивает короткую длительность действия препарата. Длительность релаксации составляет 1 / 2 – 1 / 3 от длительности нейромышечного блока недеполяризующих миорелаксантов промежуточного действия и примерно в 2–3 раза больше, чем у СХ.
22. Доза, необходимая для интубации, - 0,15–0,2 мг/кг; интубацию трахеи можно проводить через 2–2,5 мин. При дробном введении сначала 0,15 и затем еще 0,10 мг/кг интубация возможна через 1,5 мин. Препарат используется у детей старше 2 лет в дозе 0,2 мг/кг. Из-за возможного значительного выброса гистамина препарат следует вводить медленно, в течение 20–30 с.
23. Короткая длительность действия препарата дает возможность поддерживать релаксацию путем его инфузии (особенно при оперативных вмешательствах продолжительностью 30–60 мин и более). Инфузия в начальной дозе 4–10 мкг/(кг×мин) позволяет обеспечить интраоперационную миорелаксацию. При этом длительные инфузии мивакурия дают минимальное удлинение времени восстановления нейромышечной проводимости. Время восстановления не зависит от дозирования или времени инфузии препарата. Устранение остаточного блока осуществляется назначением антихолинэстеразных препаратов или донаторов ПХЭ (плазма, цельная кровь).
24. Мивакурий может быть причиной высвобождения гистамина. При быстром его введении в дозе 0,2–0,25 мг/кг могут наблюдаться преходящее понижение артериального давления и гиперемия лица. Чтобы минимизировать высвобождение гистамина, можно замедлить скорость введения миорелаксанта до 30 с. Мивакурий не блокирует автономные ганглии и не обладает ваголитическим действием.
25. Как уже указывалось, мивакурий почти полностью подвергается гидролизу ПХЭ. Через почки в неизмененном виде выделяется лишь около
5 % препарата. Метаболиты мивакурия - моноэфир мивакурия и амино-алкоголь, элиминируются с мочой и желчью. Хотя нет прямой зависимости скорости элиминации мивакурия от функции почек и печени, однако фармакодинамика препарата при печеночной или почечной недостаточности существенно нарушается, что может привести к удлинению нейромышечного блока. Например, при почечной недостаточности длительность действия мивакурия увеличивается примерно на 10–15 мин.
26. В настоящее время мивакуриум является мышечным релаксантом выбора при операциях в стационаре одного дня , при эндоскопической хирургии. Также он может быть рекомендован при операциях с непредсказуемой продолжительностью. Однако данный препарат не зарегистрирован в Республике Беларусь.
27. Аминостероидные соединения
28. Панкурония бромид (павулон). Этот длительно действующий миорелаксант первым из стероидных соединений был применен в клинике. Он является бис-четвертичным амином. Синтезирован в 1964 г. Hewett и Savage и сразу же получил признание как очень мощный миорелаксант, не обладающий гипотензивным действием. Панкуроний имеет умеренный ваголитический эффект, в связи с чем может вызывать тахикардию и повышение артериального давления . Идеально подходит для длительных оперативных вмешательств. Отсутствие выброса гистамина при его применении позволяет использовать препарат у пациентов с отягощенным аллергологическим анамнезом.
29. Умеренный ваголитический эффект панкурониума и стимуляция им симпатической нервной системы обычно служат причиной повышения ЧСС, артериального давления и сердечного выброса. Механизмы, вызывающие эти проявления, заключаются в облегчении панкуронием ганглионарной передачи , увеличении выброса катехоламинов и снижении обратного захвата катехоламинов пресинаптической мембраной.
30. Время с момента введения препарата до момента развития максимального эффекта (время начала действия) изменяется в зависимости от введенной дозы. Время начала действия при введении дозы 0,06 мг/кг
5 мин, а продолжительность действия с момента введения до момента восстановления 25 % мышечных сокращений составляет приблизительно 35 мин, до момента восстановления 90 % сокращений - 73 мин. Более высокие дозы вызывают уменьшение времени начала действия и увеличивают продолжительность.
31. Рекомендуемые дозы для интубации - 0,08–0,1 мг/кг. Хорошие условия для проведения интубации обеспечиваются в течение 90–120 с после в/в введения дозы 0,1 мг/кг и в течение 120–150 с после введения
0,08 мг/кг панкурония.
33. Дозы для поддержания интраоперационной миорелаксации - 0,01–0,02 мг/кг каждые 20–40 мин.
34. Панкуроний медленно выводится через почки в неизмененном виде. 10–20 % препарата дезацетилируются в печени. При тяжелых нарушениях функции почек и печени общий клиренс препарата снижается и значительно возрастает длительность его действия. Метаболит панкурония по мощности нейромышечного блока вдвое слабее основного соединения, но по длительности действия и кинетике аналогичен панкуронию. При использовании панкурония наблюдается ингибирование ПХЭ плазмы, что удлиняет время действия любого препарата, подвергающегося гидролизу с ее участием.
35. Пипекурония бромид (ардуан). Он является аналогом панкурония, в молекуле которого содержатся две пиперазиновые группы. Синтезирован в 1982 г. в Венгрии. Примерно на 20–30 % мощнее панкурония. Как и панкуроний, имеет длительное действие.
36. Время до развития максимума эффекта и длительность зависит от дозы. Измеряемая периферическим нервным стимулятором 95%-ная блокада достигается за 2–3 мин после введения СХ, тогда как без СХ - за 4–5 мин. Для 95%-ной нейромышечной блокады после применения СХ достаточно вводить 0,02 мг/кг препарата, эта доза обеспечивает хирургическую мышечную релаксацию в среднем на 20 мин. Блокада аналогичной интенсивности наступает без сукцинилхолина при введении 0,03–0,04 мг/кг препарата со средней длительностью эффекта в 25 мин. Длительность эффекта 0,05–0,06 мг/кг препарата составляет в среднем 50–60 мин при индивидуальных колебаниях.
37. Пипекуроний немного более мощный препарат, чем панкуроний. Доза для проведения интубации - 0,04–0,08 мг/кг, оптимальные для интубации условия наступают через 2–3 мин. В случае необходимости повторного введения рекомендуется применение 1 / 4 начальной дозы. При такой дозировке кумуляция не встречается. При введении повторных доз 1 / 2 – 1 / 3 начальной дозы можно считаться с кумуляцией эффекта. При недостаточности почечной функции не рекомендуется вводить препарат в дозе больше 0,04 мг/кг.
38. Ваголитическая активность препарата примерно в 10 раз меньше, чем у панкурония. Кроме того, пипекуроний не обладает ганглиоблокирующим действием и не высвобождает гистамин. В связи с этим он практически не оказывает влияния на сердечно-сосудистую систему, обеспечивая отчетливую кардиоваскулярную стабильность по сравнению с панкуронием. Метаболические превращения пипекурония весьма незначительны. Только около 5 % препарата подвергаются дезацетилированию в печени. Главный путь экскреции - выведение через почки. При тяжелых нарушениях функции печени и почек наблюдается замедление экскреции пипекурония и увеличение его периода полувыведения.
39. Рокуроний (зарегистрирован в Республике Беларусь в июне 2008 г.). Это стероидный релаксант средней длительности действия (30–45 мин), у которого начало нейромышечного блока проявляется раньше, чем у векурония. Длительность действия рокурония лимитируется поглощением препарата печенью и элиминацией с желчью, что объясняется его повышенной липофильностью по сравнению с векуронием.
40. Интубация трахеи возможна через 60–90 с при введении в дозе
0,5–0,6 мг/кг, что позволяет считать его альтернативой СХ при необходимости срочной интубации трахеи.
41. Доза рокурония для проведения интубации составляет 0,45–0,6 мг/кг, интубация может быть проведена в пределах 1 мин. Длительность нейромышечного блока при этом составляет 30 мин, при увеличении дозы длительность блока возрастает до 50–70 мин. Для поддержания интраоперационной миорелаксации препарат вводят болюсно в дозе 0,15 мг/кг. Инфузионная доза варьирует от 5 до 12 мкг/(кг×мин). Длительность действия
рокурония у больных в преклонном возрасте значительно увеличивается.
42. При введении в дозе до 1,2 мг/кг рокуроний оказывает минимальное влияние на сердечно-сосудистую систему как у здоровых пациентов, так и у больных с кардиоваскулярной патологией. Указанная доза не приводит к увеличению уровня гистамина в плазме. Имеющиеся указания на то, что он вызывает учащение сердечного ритма, могут быть связаны либо с болезненностью инъекции рокурония, либо с его слабым ваголитическим эффектом. В целом рокуроний практически не оказывает негативного влияния на сердечно-сосудистую систему в дозах до 0,6 мг/кг, а в более высоких дозировках (0,9–1,2 мг/кг) приводит к увеличению ЧСС на 10–25 % от исходного уровня вследствие своих ваголитических свойств.
43. Главный путь элиминации рокурония - метаболические превращения в печени. Около 10 % препарата выводится через почки. Он активно поглощается печенью при помощи активной транспортной системы переноса. Предполагаемый метаболит рокурония - 17-дезацетилрокуроний. У больных с печеночной недостаточностью (чаще всего при циррозе печени) объем распределения рокурония возрастает и его клиренс может снижаться. Длительность действия рокурония при печеночной патологии увеличивается, поэтому дозировать рокуроний у таких пациентов следует осторожно, с применением тщательного мониторинга нейромышечного блока. При почечной недостаточности плазменный клиренс рокурония также снижен, а объем распределения увеличен, однако длительность действия препарата при однократном или повторном его введении в этом случае существенно не изменяется. У пожилых пациентов длительность действия рокурония увеличена.
Дитилин - это релаксант кратковременного действия, по химическому строению ему близки листенон, миорелаксин, сукценилхолин и другие препараты.
Основные преимущества дитилина и его аналогов состоят в том, что, во-первых, он вызывает очень быстрый, но кратковременный мышечный паралич, во-вторых, при правильном применении он почти совершенно лишен токсичности, так как в организме распадается до естественных метаболитов - холина и янтарной кислоты.
Препарат хорошо растворяется в воде, растворы его переносят стерилизацию кипячением. Выпускается дитилин в ампулах по 2 мл 1 или 2% раствора, т. е. в 1 мл содержится 10 и 20 мг препарата. Часто дитилин готовится в аптеке из порошка и расфасовывается во флаконы по 50-100 мл.
Вводят его преимущественно внутривенно, а также фракционным или капельным методом.
Для облегчения интубации трахеи больным среднего веса и возраста применяются дозы 100-120 мг, для поддержания длительной релаксации повторно вводят по 40-50 мг. Больным с малым весом, истощенным, анемичным, с раковыми заболеваниями, а также пожилым указанные дозы дитилина могут быть уменьшены на 25%.
Введение соответствующей дозы через 10-20 секунд вызывает расслабление скелетной мускулатуры и мышц живота, вначале появляются мелкие подергивания мышечных волокон (фибрилляция), а затем подергивание мышц лица, шеи, конечностей. Если дитилин вводится внутривенно и быстро, то происходит фибрилляция не только отдельных волокон, но и целых групп мышц, особенно у крепких мускулистых больных, которые могут реагировать сокращением. Если дитилин вводится медленно, то резких сокращений мышц не наблюдается. Фибрилляции прекращаются через 20-40 секунд, наступает полное расслабление скелетной мускулатуры, и больной перестает дышать, то есть у него развивается состояние апноэ (отсутствие дыхания).
Максимальное действие одной дозы дитилина продолжается 3-5 секунд. По истечении этого времени у больного появляется сначала очень поверхностное дыхание, а в течение 1 -1,5 минуты полностью восстанавливается тонус мускулатуры и самостоятельное дыхание.
Так как в организме больного не происходит накапливания дитилина, то можно вводить его повторно сразу же по окончании действия предыдущей дозы. Для того, чтобы получить расслабление мускулатуры на более длительный срок, дитилин вводят повторно по 40-60 мг (4-6 мл 1% раствора или 2-4 мл 2% раствора) каждые 5-7 минут, как только начинает восстанавливаться дыхание и тонус скелетных мышц.
Для более длительного расслабления мускулатуры дитилин можно применять капельно. Сначала вводят среднюю парализующую дозу (30-60 мг), а в дальнейшем капают по 0,1 или 0,2% раствора дитилина. Для получения его 10 мл 1% или 5 мл 2% раствора добавляют к 100 мл 5% глюкозы или физиологического раствора.
Дитилин и аналогичные препараты вызывают только расслабление мускулатуры, не принося вреда организму.
Если при применении недеполяризующих релаксантов (тубарин, диплацин, парамион) возникает необходимость прекратить их действие, применяется их антидот (противоядие) - прозерин. Его вводят в конце операции в том случае, если больной плохо дышит, если плохо восстанавливается тонус. Однако следует помнить, что при полном отсутствии самостоятельного дыхания прозерин вводить нельзя. Следует дождаться периода, когда появится хотя бы очень поверхностное, но самостоятельное дыхание. Так как прозерин в этих случаях вводится в гораздо больших дозах, чем обычно, во избежание побочных действий предварительно вводят атропин. За 1 - 2 минуты до введения прозерина внутривенно вводят 0,5-0,7 мл 0,1% раствора атропина. Дозировка его зависит от пульса больного в данный момент: чем чаще пульс, тем меньше вводят атропина или совсем не вводят, а только держат шприц наготове. Если частота пульса не изменилась или он участился, то внутривенно также медленно вводят от 1 до 5 мл 0,05% раствора прозерина.
Прозерин ослабляет действие миорелаксантов двумя путями:
- угнетая холинэстеразу, он позволяет накапливаться ацетилхолину, и последний начинает вытеснять релаксанты с рецепторов концевой пластинки;
- непосредственно воздействуя на мышцу, прозерин усиливает проходимость в нервно-мышечном синапсе.
После введения прозерина тонус мускулатуры обычно восстанавливается. Если по истечении 5 минут этого не происходит и самостоятельное дыхание остается еще неполноценным, то через 5-8 минут следует ввести еще 2-3 мл прозерина (можно дробными дозами по 1 мл через 10 минут) до наступления эффекта.
Важно помнить, что дитилин не имеет антидота и прозерин не снимает, а продлевает его паралитический эффект на мышцы.
Недеполяризующие релаксанты
Недеполяриующие, или конкурентные, миорелаксанты расслабляют мышцы благодаря тому, что тормозят действие ацетилхолина в нейро-мышечном сочленении. Сейчас чаще применяются синтетические препараты - диплацин, ремиолан и др.
Диплацин - отечественный синтетический курареподобный аппарат, выпускается в ампулах, содержащих по 5 мл 2%раствора (100 мг). Мышечный паралич наступает при введении 100-200 мг. Действие начинается через 1,5-3 минуты после внутривенного введения, необходимый эффект достигается через 3-5 минут и продолжается 10-40 минут. При повторных дозах препарата затрачивается 50% раствора. Общая затрата диплацина не должна превышать 450 мг. При введении больших доз препарата (450-500 мг) в течение одной операции наблюдается очень медленное восстановление мышечного тонуса и самостоятельного дыхания.
Мышечные волокна играют важную роль в функционировании человеческого организма. В медицинской практике часто возникает необходимость, когда нужно оказать воздействие на волокна мышц с дальнейшим их расслаблением.
Миорелаксанты выступают именно такими средствами, так как их непосредственное лекарственное действие направлено на то, что бы поперечная мускулатура, а также нейромышечная пульсация стала менее выражена и сбавила свой тонус.
Миорелаксанты как средство от боли
Открытие миорелаксантов позволило медицине шагнуть вперед в лечении серьезных болезней. По данным историй яд кураре из коры растения использовали американские индейцы при охоте на животных и птиц. Яд на конце стрелы вызывал остановку дыхания у животных.
После 1942 года фармакологический рынок и аптеки постепенно наполнились лекарствами, содержащими яд кураре, а потом и синтетические вещества.
На практике применение миорелаксантов позволяет использовать их в таких направлениях:
- При лечении неврологии, на фоне ярко выраженного тонуса скелетных мышц.
- , шее или грудном отделе позвоночника.
- Перед оперативным вмешательством, в том числе и в области брюшной полости.
- При необходимости провести электросудорожную терапию .
- При анестезии с сохранением естественного дыхания.
- При восстановлении после оперативного вмешательства на позвоночнике , после травм, при развитии межпозвонковой грыжи.
Как действуют миорелаксанты?
Или спазм в мышце непосредственно влияет на подвижность суставов, блокируя и понижая их активность. Как следствие – полное отсутствие движений.
Особенно ярко выражено данное явление на фоне развивающегося остеохондроза, так как спазм полностью блокирует оптимальное функционирование мышечного волокна.
Лечение в таком случае тянется довольно долго. А миорелаксант – это возможность привести в норму общее самочувствие человека, а также умерить развивающееся воспаление. Механизм действия миорелаксантов включает блокировку нервных рецепторов всех мышц.

Действие миорелаксантов
Природные миорелаксанты
Альтернативная терапия – природная. В природных растениях содержатся натуральные вещества, обладающие таким эффектом на мышцы.
Она также позволяет , если использовать полезные свойства миорелаксантов растительного происхождения:
- Мятного масла. Оно имеет противовоспалительное воздействие, понижает боль и способствует циркуляции крови. Его небольшое количество необходимо втереть в месте напряжения мышцы. Затем оказывать небольшое массирующее движение на месте поражения не менее 5 минут.
- Валерианы. Ее свойства способны успокоить и снять воспалительный процесс в месте поражения, а также произвести оксингенацию. Для применения валерианы в качестве миорелаксанта, необходимо подготовить питье – из 10 капель настоя. Принимать не менее 500 мл в сутки.
- Соли Эпсома. Минерал позволяет понизить болевой синдром, снизить воспаление и расслабить мышцы за счет высокого содержания магния. Применение соли, возможно в виде ванн. Для этого необходимо растворить 100 г соли в воде. Курс длится 7 дней по 20 минут.
Классификация миорелаксантов
Миорелаксанты в фармакологии и медицинской терминологии имеют свою классификацию.
В зависимости от конкретного случая классификация может иметь следующее распределение на:
- Периферическое действие. Пилокарпин гидрохлорид, Прозерин, Атропин сульфат, Метацин.
- Центральное воздействие. К таким относят препарат Миокаин, Мидокалм, Сибазон.
Пилокарпин гидрохлорид Прозерин Атропин сульфат Метацин
В зависимости от длительности действия препараты могут быть:
- Длительного воздействия. Эта категория включает препараты Тубокуроин, Баклофен.
- Среднего влияния. Препараты данной группы – Атракуриум, Цисатракуриум.
- Короткого воздействия. Препарат – Мивакуриум.
- Ультрабыстрого применения . К этой категории относят Листенон, Дитилин.
- Смешанного действия. Применяют при необходимости обеспечить немедленную локальную релаксацию мышечного волокна.
Листенон Дитилин Артракуриум для инъекций
Миорелаксанты центрального действия
Действие таких препаратов различают в зависимости от принадлежности по химическому составу:
- глицеринопроизводные;
- бензимидазольные;
- смешанные.
Препараты позволяют оказать блокировку всех рефлексов, содержащихся в синапсисе мышцы. Блокировка происходит за счет подавления нейронов в спинном мозгу. Таким образом, проявляя расслабляющие воздействие, их применение позволяет купировать многие заболевания, имеющие один распространенный симптом – повышенный тонус в мышце.
Применение этой группы лекарств может позволить исключить спазм при возможности сохранить естественное дыхание (отсутствие наркоза).
Миорелаксанты периферического действия
Такие препараты блокируют или деполяризуют нервный импульс, поступающий к мышечному волокну. Особенно часто применимы на фоне используемого наркоза, при параличе и судороге.
Имеют подразделение на:
- недеполяризиющие;
- деполяризирующие;
- смешанные.

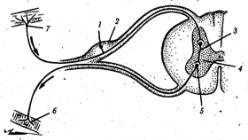
Передача нервных импульсов в мышцы
Препараты такой группы очень эффективны на фоне развитой мышечной боли и спазмах, так как оказывают воздействие на холинорецепторы в мышцах скелета. Такое свойство позволяет использовать их при необходимости провести оперативное вмешательство.
Деполяризующие миорелаксанты
Препараты, относящиеся к такой группе, имеют гибкую линейную структуру.
На практике применяется один – Сукцинилхолин, который имеет быстро воздействие с короткой продолжительностью:
- При воздействии оказывает кратковременное сокращение мышц, а затем плавно их расслабляет.
- Однако имеет ряд побочных эффектов, в частности – повышение артериального и внутричерепного давления, гипертермию, аритмию и послеоперационную миалгию.
- Действие таких препаратов в части блокады наблюдается в течение первых 40 секунд после укола или введения, а продолжительность – 6 минут.
Недеполяризующие миорелаксанты
Выбор препаратов данной группы более обширный. Каждый из них имеет свое индивидуальное свойство, определенное структурой.
Имеют антагоническое воздействие, то есть, вызывают блокаду в нейромышечной системе на протяжении 5 минут, длительность которой варьируется от 15 до 60 минут. Блок полностью прекращается по мере поступления в организм препаратов — антихолинэстеразных.
Курареподобные миорелаксанты
Действуют курареподобных миорелаксантов такое же, как природного яда кураре. Вызывают релаксацию и расслабление спазм скелетных мышц человека через блокировку нервной передачи в волокна мышцы.
Это миорелаксанты перефирического действия:
- Веркурония бромид.
- Дитиллин.
- Мелликтин.
Показания к применению
Независимо от типа препарата, прием каждого из них должен быть осуществлен только при условии консультации с лечащим врачом. Помимо этого прием таких препаратов должен быть подтвержден, соответствовать определённым требованиям.
В частности речь идет о:
- Действие препарата при применении должно быть селективным , то есть держать на пониженном уровне мышечный тонус и пульсацию мышц.
- Он должен быть безопасным при условии длительного использования.
При остеохондрозе поясничного и шейного отделов
Довольно распространенный недуг – . Его проявление выражается в боли в спине. Один из наиболее тревожных сигналов при развитии болезни – мышечной спазм. Показания к примененю в терапии перапартов-миорелаксантов позволит произвести расслабление.
К таким препаратам относят:
- Его используют независимо от локализации остеохондроза.
- Сирдалуд или Тизанидин , который полностью купирует спазм.
- Баклофен применим при лечении пояснично-крестцового остеохондроза. Имеет множество противопоказаний.
Мидокалм расслабляет мышцы Сирдалуд в таблетках Баклофен Тизанидин
При коксартрозе
Позволяет минимизировать болевой спазм в мышце, тем самым восстановив подвижность тазобедренного сустава.
Однако необходимо проявить особую осторожность, так как на фоне развития коксартроза, прием любых препаратов может сделать только хуже. Назначают препарат Баклосан, Катадолон или для понижения спазмического процеса.
Баклосан Катадолон
При остеоартрозе
Развивается довольно болезненно еще с начального этапа, провоцируя мигрень и дискомфорт. При этом естественная реакция организма – боль на движения шей и напряжение мышц.
Развитие остеоартроза купируется таким препаратом, как так как именно его терапевтическое воздействие позволяет добиться восстановления биомеханики сустава.
При грыже позвоночника
На фоне развивающейся грыжи миорелаксанты – единственное верное решение в терапии, так как без них купировать боль, которую вызывает , невозможно:
- Они способствуют подавлению болевых импульсов на центральном уровне, расслабляя мускулатуру, снимают спазмы.
- Как правило, в таком случае применяют Баклофен, так как он способствует нормализации подвижности, несмотря на ряд побочных свойств.
При артрозе суставов, ишиасе и радикулите
Поражают абсолютно все – мышцы, суставы, особенно те, которые активно задействованы в движении. сопровождается болью и напряжением в пояснице и нижних конечностях.
Применение миорелаксанта в таком случае — вынужденная мера:

- Применение направлено, прежде всего, на восстановление двигательной функции.
- Такие препараты, как Мидокалм и Сирдалуд снимают спазм и минимизирует мышечную боль, нормализуют кровообращение.
- Также препараты могут тормозить возбудительные процессы, которые идут от нерва к мышце
Применяют такие препараты внутримышечно по 1,0 мл два раза в день. Через несколько дней принимают таблетки, в зависимости от индивидуального случая выраженности тонуса мышцы.
При невралгии
Лечебный процесс при невралгии основан на применении средств, которые снимут симптомы и причины заболевания. Миорелаксанты будут устранять и расслаблять напряжение в мышцах, способствуюя дальнейшему успешному лечению за счет прямого воздействия, ярко выраженная миалгия притупляется, а значит терапевтический эффект достигается быстрее.
В комплексной терапии с нестероидными анальгетиками, противовоспалительными препаратами миорелаксанты позволяют достичь максимально полезного результата.
Невралгия восстанавливается с помощью введения внутримышечно (1 мл дважды в сутки) или Клоназепама.
При люмбалгии
Такой синдром, как , требует вмешательства и контроля со стороны ортопеда и невропатолога. Помимо постельного режима, назначают спазмолитик Толперизон, Сирдалуд , которые помогают снизить спазматичность, уменьшают напряжения и спазм в мышцах.
Сирдалуд в таблетках Толперизон
Миорелаксанты для лица
Помимо лечения разных патологий, прекрасно себя зарекомендовали препараты данной группы в косметологии. В частности, как средства от морщин.
Как показали данные исследований, снизить количество и глубину морщин за счет применения косметики с миорелаксантом и данных препаратов удалось более чем на 25 %, а проявление мимических складок снизилось до 90%. Среди них препараты, содержащие токсин ботулизма, — Ботокс, Диспорт, Ланекс, крем Кора.
Крем Кора Ботокс Диспорт
Миорелаксанты в анестезиологии
Как только в медицинской практике стали применяться миорелаксанты, можно было говорить о новой эре развития анестезии при хирургии, так как применение решило множество задач, включая:
- Возможность полностью обездвижить пациента и расслабить мышцы при операции.
- Проводить ИВП.
- Проводить интубацию трахей.
- Исключить дрожание мышц.
- Снять спазмы при столбняке, бешенстве, судорогах.
Применение в анестезиологии подразумевает выбор препарата для внутривенного или местного введения в каждом случае – индивидуально. Этот могут быть Круарон, Дитилин.
Круарон Дитилин
Как принимать миорелаксанты?
Прежде всего, назначением такой группы препаратов должны заниматься соответствующие специалисты – вертебролог или невролог. Принимая их бесконтрольно или назначая их самостоятельно, можно только усугубить состояние здоровья, это просто опасно. Поэтому прием должен быть строго по инструкции. К тому же есть риск развития побочных эффектов.
Среди наиболее часто применимых препаратов – Мидокалм или Толперизон.
Основные принципы применения Мидокалма:
- Взрослые получают дозировку Мидокалма по 2 раза в день 50 мг.
- В зависимости от достигнутого эффекта, дозировка постепенно понижается или увеличивается – до 150 мг за два приема.
- Принимают препарат после еды.
- Инъекции Мидокалма могут быть назначены при сильных болях в мышце, спазмах, которые нарушают биомеханический процесс позвоночника.
- Также, лечение назначают при мышечных спазмах в позвонках. Вводятся инъекции два раза в день не менее 1 мл.
Применение препаратов не должно дублировать друг друга, то есть единовременно можно использовать только один препарат. Каждый из видов лекарств имеет свои рекомендации по применению, дозировке, частоте и т.д.
Независимо от названия, все выпускаются в таблетированной форме, инъекции используются при условии оказания экстренной помощи, чтобы эффект был достигнут максимально быстро для активных действий со стороны специалистов. Существуют также в форме мазей.
Противопоказания
Применение препаратов может нанести вред при наличии:
- Алкоголизма.
- Миастении.
- Аллергии на составляющие препарата.
- Язвенной болезни.
- Болезни Паркинсона.
- Эпилепсии.
- Расстройстве со стороны психики.
- При почечной недостаточности и патологии со стороны почек.
- При печеночной недостаточности.
- В детском возрасте до 1 года.
- При беременности и в период лактации.
Взаимодействие с другими препаратами
Применение препаратов на фоне приема иных средств должно быть максимально взвешенным, так как одни препараты усиливают терапевтическое воздействие, а другие напротив – ухудшают состояние. О совместимости препаратов может информировать только специалист.
Применение препаратов миорелаксантов с аминогликолидами, линкозамидами, гликопептидами усиливает нервно-мышечную блокаду, повышает риск угнетения дыхания, приводит к его полной остановке.
А вот препараты группы полимиксинов напротив повышают терапевтический эффект.
Миорелаксанты и алкоголь
Применение препаратов данной группы полностью исключает в рационе алкоголь. Алкоголь негативно влияет на нервную систему, возбуждая ее и провоцируя подачу импульсов в мышечную ткань. Более того, его абсорбция концентрируется в печени, вовлекая за собой цепочку негативной химической реакции, угнетая общее состояние больного.
Лучшие современные миорелаксанты
В данной таблице представлены самые современные и эффективные лекарства — миорелаксанты.
| Название препарата | Свойства | Форма выпуска | Средняя стоимость |
| «Баклофен» | Действие направлено на регулирование чувствительности в спинном мозгу. | Таблетированная форма | 420 рублей |
| Действие направлено на воздействие коры головного мозга. | Инекции, Таблетированная форма | 398 рублей | |
| «Толперил» | Действие направлено на снижение гипертонуса мышц, имеет смазмолитический эффект. | Таблетированная форма | 260 рублей |
| Действие направлено на снижение гипертонуса, влияние на кору головного мозга. | Таблетированная форма | 700 рублей | |
| «Тизанил» | Действие направлено на понижение гипертонуса и регидности мышц. | Таблетированная форма | 235 рублей |
| «Спазмол» | Обезболивающий эффект. | Таблетированная форма | 110 рублей |
| «Биошпа» | Понижает болевой симптом. | Таблетированная форма | 300 рублей |
Осложнения и побочные эффекты
Назначение миорелаксантов позволит забыть о боли в пояснице, однако необходимо быть ознакомленным о проявлении негативных моментов и побочных эффектов:

- Понижение концентрации внимания.
- Понижение артериального давления.
- Нервозность.
- Недержание мочи.
- Появление судороги и аллергической сыпи.
- Расстройства системы ЖКТ.
Если есть хоть одно проявление из вышеперечисленного, то можно говорить о передозировке препаратом, особенно из группы антидеполяризующих.
Даже препараты последнего поколения имеют побочные эффекты и осложнения. Меры купирования проявления тревожных симптомов должны начинаться с полного прекращения приема, а также незамедлительного консультирования с врачом. Терапия отравления и передозировки начинается с введения раствора Прозерина.
Передозировка
При обычной передозировке каким-либо из препаратов-миорелаксантов необходимо произвести искусственное дыхание до его восстановления. Помимо этого, в вену очень острожно вводят антидот – Физостигмин, Салицилат, Нео Эзерин . Все это делается с четким контролем артериального давления.
В дальнейшем необходимо произвести инфузию плазмозамещающих растворов, кислородного дыхания. Необходима симптоматическая терапия, которая направлена на восстановление сердечно-сосудистой недостаточности.
Миорелаксанты без рецептов
Как правило, эти препараты относятся к так называемому списку А – то есть для их приобретения необходим рецепт. Однако без рецепта можно приобрести безрецептурные препараты — Мидокалм, Сирдалуд, Тизалуд.
Заключение
Независимо от того, какое заболевание настигает человека, обойтись без должно лечения невозможно. В роли спасательного круга от возникновения болей выступают соответствующие препараты – миорелаксанты. Они позволяют организму получить необходимые вещества, которые благотворно влияют на мышечную ткань, тем самым купируя болевой синдром.